脳梗塞後の神経再生メカニズム―神経細胞の移動促進により神経機能が改善― についての論文が掲載されました。A new strategy for brain regeneration after stroke: clearing the path for migrating neurons
金子准教授らの新しい論文がScience Advances誌に掲載されました。
Kaneko N, Herranz-Pérez V, Otsuka T, Sano H, Ohno N, Omata T, Nguyen HB, Thai TQ, Nambu A, Kawaguchi Y, García-Verdugo JM, Sawamoto K.
New neurons use Slit-Robo signaling to migrate through the glial meshwork and approach a lesion for functional regeneration
Sci Adv 4: eaav0618 (2018)
脳梗塞は、脳血管の閉塞により血流が途絶して神経細胞が死滅する疾患で、様々な神経機能の障害が生じます。まだ脳が深刻なダメージを受けていない急性期に、閉塞した血管を再開通させる治療法は、近年目覚ましく発達しました。しかし、成熟した脳では神経細胞を再生する能力がほとんどないため、この時期を過ぎると抜本的な治療法がないのが現状で、我が国で、寝たきりの原因となる主な疾患のひとつです。神経細胞の大部分は胎生期に幹細胞からつくられますが、成熟過程でほとんどの幹細胞は消失します。そのため、成熟後の脳内では、脳室の周囲にある「脳室下帯」などごく限られた領域でしか神経細胞が作られません。脳室下帯で生まれた未熟な神経細胞は、脳梗塞後には傷害部に向かって移動して成熟し、神経細胞を再生しようとしますが、神経機能の障害を十分に回復させることはできません。本研究では、三次元的な電子顕微鏡解析法や、脳梗塞後の脳切片を移動する生きた神経細胞の挙動を記録するライブイメージングという方法で、ダメージを受けた脳組織で活性化して増殖・肥大化するアストロサイトと呼ばれる細胞が、神経細胞の移動を妨げていることを発見しました。
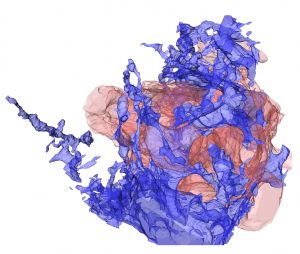 また、神経細胞が活性化アストロサイトの間をスムーズにすり抜けるのに必要なスリットという蛋白質を同定しました。神経細胞が分泌したスリットが、活性化アストロサイトの細胞表面にあるロボというタンパク質(受容体)に結合すると、細胞の骨組みをつくる蛋白質の動態が変化して活性化アストロサイトの形が変わり、神経細胞がすり抜けやすくなります。しかし、スリット蛋白質は、傷害部への移動の途中で減少していくため、神経細胞は十分に移動することができません。そこで、神経細胞のスリット蛋白質の産生を増加させる処置を行うと、脳梗塞後の脳組織内での神経細胞の移動を促進することができました。その結果、傷害部の近くまで移動して成熟する神経細胞の割合が増加し、それに伴って脳梗塞によって生じた運動機能の障害が改善しました。この研究から、損傷後の脳内で、新しい神経細胞の移動をコントロールして適切な場所に配置することが、脳機能の再生に重要であるということが分かりました。この研究で明らかになった脳の再生の仕組みは、脳疾患に対する再生医療の実現に向けても重要なものです。
また、神経細胞が活性化アストロサイトの間をスムーズにすり抜けるのに必要なスリットという蛋白質を同定しました。神経細胞が分泌したスリットが、活性化アストロサイトの細胞表面にあるロボというタンパク質(受容体)に結合すると、細胞の骨組みをつくる蛋白質の動態が変化して活性化アストロサイトの形が変わり、神経細胞がすり抜けやすくなります。しかし、スリット蛋白質は、傷害部への移動の途中で減少していくため、神経細胞は十分に移動することができません。そこで、神経細胞のスリット蛋白質の産生を増加させる処置を行うと、脳梗塞後の脳組織内での神経細胞の移動を促進することができました。その結果、傷害部の近くまで移動して成熟する神経細胞の割合が増加し、それに伴って脳梗塞によって生じた運動機能の障害が改善しました。この研究から、損傷後の脳内で、新しい神経細胞の移動をコントロールして適切な場所に配置することが、脳機能の再生に重要であるということが分かりました。この研究で明らかになった脳の再生の仕組みは、脳疾患に対する再生医療の実現に向けても重要なものです。
Stroke is a leading cause of death and chronic disability in adults, causing a heavy social and economic burden worldwide. However, no treatments exist to restore the neuronal circuitry after a stroke. While most neurons are generated during embryonic brain development, new neurons continue to be produced in the ventricular-subventricular zone (V-SVZ) of the adult brain. In rodent olfaction, immature new neurons called neuroblasts form chain-like aggregates that migrate to the olfactory bulb, where they differentiate into interneurons. However, in the case of brain injury, the mammalian brain has only a limited ability to regenerate neuronal circuits for functional recovery. In a rodent ischemic stroke model induced by transiently blocking the middle cerebral artery, the most commonly affected vessel in human patients, some V-SVZ-derived neuroblasts migrate toward the lesion, where they mature and become integrated into the neuronal circuitry. However, the number of these new neurons is insufficient to restore neuronal function.
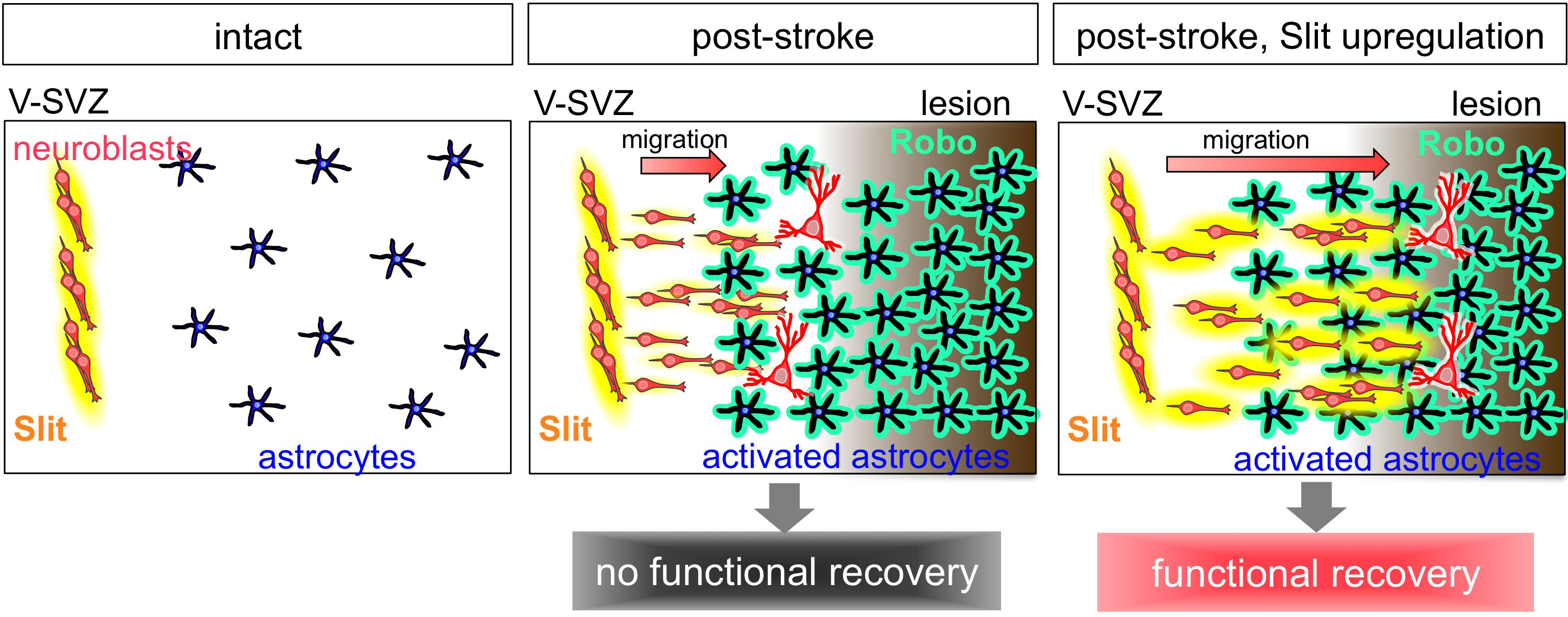
We have revealed a novel mechanism for neuronal regeneration, using the mouse model for ischemic stroke. Within a few days after stroke, astrocytes, a major population of macroglia, in and around the injured area become activated, exhibiting larger cell bodies, thicker processes, and proliferative behavior. The migrating neuroblasts must navigate through this astrocyte meshwork to reach the lesion. Using three-dimensional electron microscopy and live imaging, the research team demonstrated that neuroblast migration is restricted by the activated astrocytes in and around the lesion. In normal, olfaction-related migration, neuroblasts secrete a protein called Slit, which binds to a receptor called Robo expressed on astrocytes. Slit alters the morphology of activated astrocytes at the site of neuroblast contact, to move the astrocyte surface away and clear the neuroblast’s migratory path. However, in the case of brain injury, the migrating neuroblasts actually down-regulated their Slit production, crippling their ability to reach the lesion for functional regeneration. Notably, overproducing Slit in the neuroblasts enabled them to migrate closer to the lesion, where they matured and regenerated neuronal circuits, leading to functional recovery in the post-stroke mice. These results suggest that strategies designed to help migrating neurons reach the lesion may improve stem/progenitor cell-based therapies for brain injury.

筆頭著者による研究内容の解説はこちら



