Highlights
2025 成長円錐のライブイメージングおよび光操作に関する手法
Sawada M, Nakajima C, Umeda E, Takagi Y, Nakashima N, Vepřek NA, Küllmer F, Nasufović V, Arndt HD, Trauner D, Igarashi M, Sawamoto K.
Time-lapse super-resolution imaging and optical manipulation of growth cones in elongating axons and migrating neurons.
Bio-protocol 15: e5251 (2025)
当時特任助教だった中嶋さん(現・名古屋大学理学部助教)と進めた、移動するニューロンにおける成長円錐の同定と新しい神経再生促進技術の開発に関する論文(Nakajima et al., Nat Commun, 15:1877, 2024)が発表された後、この論文で用いたさまざまなライブイメージング法や光操作技術をプロトコル論文としてまとめることとなり、澤田が中嶋さんと協力して執筆しました。
脳室下帯の新生ニューロン培養や基本的なイメージング技術については、実は2020年に同じBio-protocol誌(Sawada et al., Bio-protocol 10: e3823, 2020)に詳細を掲載していたため、今回の論文では、軸索の培養方法やストライプアッセイ、光制御性細胞骨格阻害剤を用いた光操作、機械学習を用いた成長円錐形態の抽出を中心に記載しています。Filopodia一本レベルの光操作が可能な(マニアックな)技術でありますが、filopodiaに限らず細胞骨格が関与するシーンなら適用可能だと思いますので、今後の澤本研のプロジェクトにもぜひ活用していただきたいです。また、2020年のBio-protocol誌に続き、再びBio-protocol誌の表紙を獲得できたのは良い思い出です。(澤田 雅人)
2025 傷害部へ向かって移動する新生ニューロンのトランスクリプトーム解析
Miyamoto T, Kuboyama K, Honda M, Ohkawa Y, Oki S, Sawamoto K.
High spatial resolution gene expression profiling and characterization of neuroblasts migrating in the peri-injured cortex using photo-isolation chemistry
Front Neurosci. 7:18:1504047 (2025)
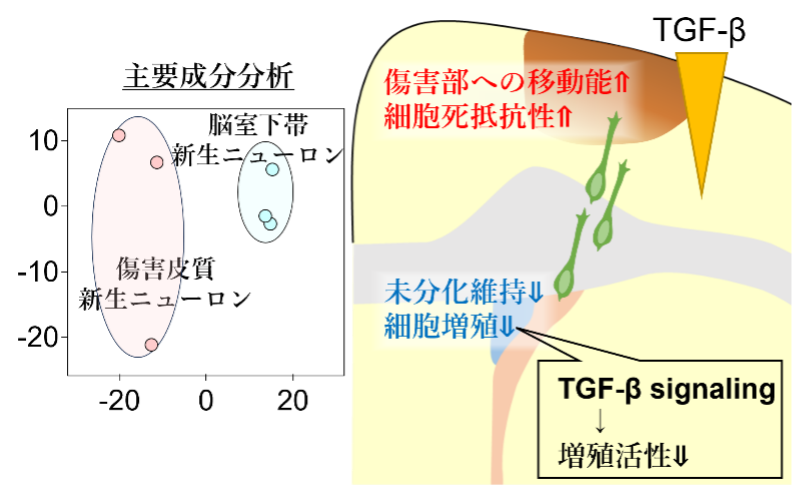
脳が傷害を受けると、脳室下帯で産生された新生ニューロンの一部が傷害部へ向かって移動することが知られています。本研究では、脳傷害後に傷害部へ移動する新生ニューロンはどのような特徴を持つのかを明らかにしました。解析には、空間トランスクリプトーム法の一つであるPhoto-isolation chemistry (PIC) 法 (Honda et al., STAR Protocols, 2022) を用いました。この技術により、特定の場所に存在する細胞が発現している遺伝子を調べることができます。我々はこの技術を用いて、脳室下帯に分布する新生ニューロンと、傷害部へ向かって移動する新生ニューロンの遺伝子的特徴を比較しました。その結果、窓外部へ向かって移動する新生ニューロンと脳室下帯に分布する新生ニューロンでは異なった遺伝子発現プロファイルを有していることを明らかにしました。傷害部へ向かって移動する新生ニューロンでは、傷害部への移動能や細胞死抵抗性に関わる遺伝子の発現が上昇している一方で、未分化状態の維持や細胞増殖に関わる遺伝子の発現が低下していることが明らかになりました。さらに、この細胞増殖に関連する遺伝子の発現低下には、傷害部から分泌されるTransforming Growth Factor-β (TGF-β) が関与している可能性を見出しました。本研究で得られた知見は、傷害を受けた脳に対する再生医療の開発に貢献することが期待されます。
私は学部1年生のころから澤本研究室のメンバーとして研究に取り組んできました。当初は自分のプロジェクトを持たず、大学院生の先輩方の研究をサポートする形で関わっていました。大学院に進学し自分のプロジェクトを持つにあたり、「傷害を受けた脳の再生を研究したい」「今後も発展が期待されるオミクス研究に携わりたい」と考えていました。そんな中で、さまざまなご縁が重なり、本プロジェクトがスタートしました。澤本先生や指導教官の久保山先生には、実験のトラブルシューティングからデータの解釈、論文の構成や深い考察に至るまで、未熟な私に対して丁寧かつ熱心にご指導いただきました。そのおかげで、本研究をこのような形にまとめることができました。また、共著の先生方やラボメンバーの皆様にも多大なご協力をいただきました。この場をお借りして、心より感謝申し上げます。(宮本 拓哉)
2025 神経幹細胞の維持における出生の意義
Kawase K*, Nakamura Y*, Wolbeck L*, Takemura S*, Zaitsu K, Ando T, Jinnou H, Sawada M, Nakajima C, Rydbirk R, Gokenya S, Ito A, Fujiyama H, Saito A, Iguchi A, Kratimenos P, Ishibashi N, Gallo V, Iwata O, Saitoh S, Khodosevich K, Sawamoto K. (*equal contribution)
Significance of birth in the maintenance of quiescent neural stem cells.
Sci Adv. 11(4):eadn6377 (2025)
.png)
「出生」は生体にとって最大のライフイベントです。子宮内から子宮外へと環境が変化することによって、生体にはさまざまな代謝変動が引き起こされます。しかし、「出生」というイベントが生体の発達過程においてどのような意義をもつのか、その多くは謎に包まれたままです。本研究では、出生によって引き起こされるグルタミン代謝変動によって、胎児期の神経経幹細胞である放射状グリア細胞が静止的な状態を獲得し、生後の神経幹細胞としての長期間の維持が可能になることを明らかにしました。早産で出生すると、このプロセスが障害され、放射状グリア細胞が一時的に過剰に活性化することを見出しました。この結果、早産では神経幹細胞が枯渇し、生後のニューロン新生が低下することがわかりました。
私は小児科の先輩である神農英雄先生に続き、大学院生として2015年に澤本研に入門しました。研究テーマが与えられるわけではなく、新生児科医である私と、脳科学者である澤本先生とがともに共鳴するテーマをひたすら考える日々が続きました。その結果、「出生」というキーワードに辿りついたときには大学院3年生となっていました。そこからも、出口の見えない日々が続き、いつしか大学院生活も終了、臨床現場に戻りながら研究を継続する日々に突入しました。そのような状況のなか、多くの皆さまの協力のもと、なんとかアクセプトまで辿りつくことができました。
澤本先生には研究の成果が一向に出ない苦しい時期にも、つねに何か新しい発見につながるヒントを見出せないか、というポジティブな視点でディスカッションしていただきました。研究生活で一番思い出に残っているのは、ある日のノートチェックで「“出生”って生命の進化(水中から外に出る)と同じだ!」と、みんなで興奮したことです。添付のイラストは、この興奮を表現したものです。論文中でも考察として記していますので、ぜひご一読いただければ幸いです。澤本研究室で得られた知見を、臨床に還元していくことが私の役目だと感じています。これからも澤本研の皆さまと協働して、研究を続けていきたいと考えています。最後になりましたが、澤本先生をはじめ、共著の先生方、研究生活を支えていただいたすべての皆さまに、この場を借りて感謝申し上げます。(川瀬恒哉)
2024 嗅球におけるアストロサイト活性化は血流増加を引き起こす
Takashi Ogino, Masakazu Agetsuma, Masato Sawada, Hiroyuki Inada, Junichi Nabekura and Kazunobu Sawamoto.
Astrocytic activation increases blood flow in the adult olfactory bulb
Mol Brain 17:52(2024)
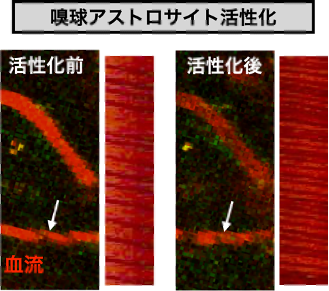
脳で神経活動が生じると、その領域の血管を流れる血流が増加することが知られています。この仕組みは、神経活動に伴って多くのエネルギーを消費する神経細胞への栄養供給にとって有用であると考えられています。神経細胞が興奮すると、そのシグナルは他の細胞によって媒介され、最終的に血管径が変化することで血流が増加します。本研究では、脳血流増加を仲介するアストロサイトの働きに着目しました。
澤本研究室では、嗅球で生じるニューロン新生に着目して研究を行っており、嗅球における新生ニューロンの移動が血流に依存することを最近報告したばかりです。嗅球での血流制御の仕組みを解明することは、ニューロン新生の研究にとっても重要な手がかりとなることが期待されるのですが、皮質など他の脳領域と比べて、嗅球内の血流増加の仕組みは未解明なところが多いです。
嗅覚入力後にアストロサイトが活性化し、嗅球の血流が増加することが知られていましたが、アストロサイトを活性化させるだけで血流増加が生じるどうかは分かっていませんでした。それを調べるために、私たちは、DREADDという人為的に細胞を活性化させる技術を用いて、アストロサイトの活性化を誘導しました。血管上でラインスキャンを行うことで、単位時間あたりに流れる赤血球(図の黒い影)の数を定量しています。これらの方法を用いて実験を行った結果、アストロサイトの活性化が、嗅球内の血流増加にとって十分であることが明らかとなりました。
本研究は、澤本先生、澤田先生のご指導のもと、生理学研究所の鍋倉先生、揚妻先生の多大な援助によって論文としてまとめることができました。感謝申し上げます。(荻野)
2024 正常脳内と傷害脳内における新生ニューロンの移動メカニズムの解明および脳傷害を再生させる新規治療法の開発
Matsumoto M, Matsushita K, Hane M, Wen C, Kurematsu C, Ota H, Nguyen HB, Thai TQ, Herranz-Pérez V, Sawada M, Fujimoto K, García-Verdugo JM, Kimura KD, Seki T, Sato C, Ohno N, Sawamoto K.
Neuraminidase inhibition promotes the collective migration of neurons and recovery of brain function
EMBO Mol Med 10.1038/s44321-024-00073-7. (2024)
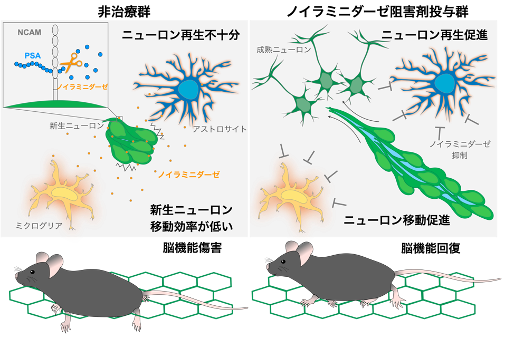
成体脳の脳室下帯の神経幹細胞から産生された新生ニューロンは、正常脳および傷害脳においても互いを足場にしながら鎖状に連なって移動することが知られています。しかし、一見同じように鎖状形成している新生ニューロンも正常脳では高速移動するのに対し、傷害脳内では移動効率が低いことが知られていました。なぜ、正常脳と傷害脳内を移動する新生ニューロン間にこのような違いが生じるのかは不明でした。この論文では、正常脳内の新生ニューロンの間には多くの非接着領域が存在しているのに対し、傷害脳では非接着領域が減少し、細胞接着が過剰になりすぎてしまうことが明らかとなりました。この非接着領域はポリシアル酸(PSA)によって維持されており、脳傷害によってPSAを切断する酵素ノイラミニダーゼが発現上昇することによって、新生ニューロンのPSAが減少してしまうことが分かり、これが傷害脳内における新生ニューロンの移動効率低下の一因になっていることが分かりました。そこで、ノイラミニダーゼを抑制する阻害剤として抗インフルエンザ薬を傷害脳に投与したところ、傷害部へのニューロン移動の促進、ニューロン再生、脳機能の回復が認められました。さらに、傷害脳への抗インフルエンザ薬投与によるニューロン移動促進効果は霊長類においても確認され、脳梗塞の再生医療への応用が期待されます。
この論文は、私が博士課程の頃から進めてきた研究プロジェクトをまとめたもので、約8年の歳月がかかりました。博士課程在籍当初は、この研究テーマを学位論文にすることを計画しておりましたが、博士課程の期間中では論文を書き上げるところまでは到達できず、2019年に論文化した別のテーマで学位を取得しました。長い期間かかってしまいましたが、自身で立ち上げた研究プロジェクトを無事に論文として形にできたことは、私にとって大きな経験であり、大切な論文となりました。この論文には多くの共同研究の先生方にご尽力いただきました。ご尽力いただきました全ての方に感謝申し上げます。また、私の思いを汲み取り、熱心にご指導いただきました澤本先生には大変お世話になりました。日頃から感謝の気持ちでいっぱいですが、改めてこの場を借りて、重ねて感謝申し上げます。最後になりましたが、お世話になりました研究室の皆様にもお礼を申し上げたく存じます。誠にありがとうございました。(松本真実)
2024 新生ニューロン移動における血流の役割
Ogino T*, Saito A*, Sawada M, Takemura S, Nagase J, Kawase H, Inada H, Herranz-Pérez V, Mukouyama Y, Ema M, García-Verdugo JM, Nabekura J and Sawamoto K. (*equal contribution)
Neuronal migration depends on blood flow in the adult brain
eLife 99502.1 (2024)
図1.png)
成体マウスの脳室下帯で産生された新生ニューロンは、嗅球へと移動した後で成熟し、神経回路に組み込まれます。新生ニューロンは移動する際に血管を足場とすることが知られていましたが、血管を流れる血液が、移動中の新生ニューロンにどのような影響を与えるのかは、これまで分かっていませんでした。
本研究では、生きたマウスの脳内を2光子顕微鏡を用いて観察することで、新生ニューロンが血流の多い血管に沿って移動し、成熟ニューロンへと分化することを明らかにしました。新生ニューロンの移動には血液の流れが必要であり、血流が多いほど、移動速度は大きくなります。
新生ニューロンの移動が血流に依存することから、血液の中に移動を促進する何らかの因子が含まれているのではないかと考えました。その候補として着目したのが、空腹時に胃で産生される末梢ホルモンのGhrelinです。私たちは、Ghrelinが新生ニューロンの移動を促進するメカニズムとして、細胞体後部におけるアクチン重合活性化を明らかにしました。
本研究は、co-first authorの斎藤さんはもちろんのこと、澤本先生、澤田先生をはじめとする共著者の方々のご尽力により形にすることができました。この場を借りて、感謝申し上げます。(荻野)
2024 新生ニューロンの成長円錐を同定―傷害脳における新たな移動促進機構―
Nakajima C*, Sawada M*, Umeda E, Takagi Y, Nakashima N, Kuboyama K, Kaneko N, Yamamoto S, Nakamura H, Shimada N, Nakamura K, Matsuno K, Uesugi S, Vepřek NA, Küllmer F, Nasufović V, Uchiyama H, Nakada M, Otsuka Y, Ito Y, Herranz-Pérez V, García-Verdugo JM, Ohno N, Arndt HD, Trauner D, Tabata Y, Igarashi M, Sawamoto K. (* equal contribution)
Identification of the growth cone as a probe and driver of neuronal migration in the injured brain
Nat Commun 15, 1877 (2024).
新生ニューロンの先端部と成熟ニューロンの成長円錐が共通している、という澤本先生が長年温めてきた構想を本論文で発表することができました。さらに、同定した成長円錐が持つ機能を応用することで、新生ニューロンの移動を脳傷害部でも促進することを可能とした点が本論文のミソです。
成熟途中の神経細胞の成長円錐は周囲の分子を認識するアンテナの役割を担い、軸索伸長とその方向を調節する司令塔の機能が備わっていることは古くから知られています。本論文では、新生ニューロンの先導突起先端部にも成長円錐があることを本論文で同定し、成長円錐が細胞外環境を認識することで移動を調節していることを明らかとしました。さらに、新生ニューロンの成長円錐の機能を活用することで、傷害脳でも新生ニューロンの移動を促進させ、歩行機能の回復を遂げることができました。専門分野が異なる多くの共著者から成る論文でして、皆様のご幇助のもと、説得力のある論文となりました。この場をお借りして、感謝申し上げます。

本テーマは皆様の縁から為ったテーマでした。まだ、私が研究室に参加する前から、澤本先生が五十嵐先生(新潟大学)と議論されたことが本研究テーマの土台となりました。その後、澤本先生がAMED-CRESTから研究費を獲得されたことで、私は首の皮一枚で存続できています。開始当初は、自分はマテリアルとHSPGの探索と選定していた一方で、久しぶりに神経細胞の培養・遺伝子導入をし、あらためてその美しさに触れることができました(澤田さん、梅田さんによる超解像顕微鏡の動画が美しいです!)。スライス培養では、マテリアルを保持したままの脳切片を得るには、brain chopperが必要でした。ポスドク時代にchopperを目にしたからこそ、その案に辿りつけました(ビブラトームは万能ではない)。色々な巡り合わせのおかげで、脳内をクレバーに移動している新生ニューロンの挙動を可視化することができました。澤本先生、澤田先生との楽しいディスカッションと、素敵な論文が仕上がる過程が一番の思い出です。今後も、neuroscienceって面白い!と思ってもらえる仕事を発信し続けられれば、と思います。(中嶋)
2023 脳傷害後の神経再生を促す超分子バイオマテリアル
Yuya Ohno*, Chikako Nakajima*, Itsuki Ajioka, Takahiro Muraoka, Atsuya Yaguchi, Teppei Fujioka, Saori Akimoto, Misaki Matsuo, Ahmed Lotfy, Sayuri Nakamura, Vicente Herranz-Pérez, José Manuel García-Verdugo, Noriyuki Matsukawa, Naoko Kaneko#, Kazunobu Sawamoto#. (*equal contribution)(#co-correspondence)
Amphiphilic peptide-tagged N-cadherin forms radial glial-like fibers that enhance neuronal migration in injured brain and promote sensorimotor recovery
Biomaterials 294, 122003(2023).
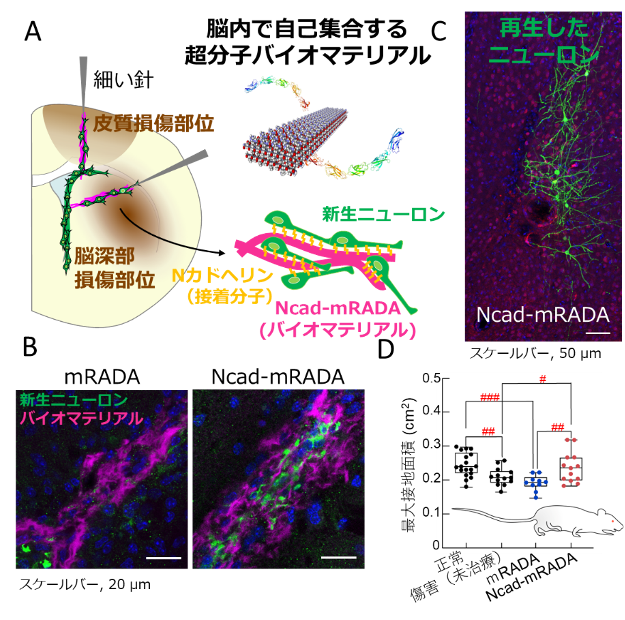
成体哺乳類の脳では特定の領域で内因性の神経幹細胞から新しく神経細胞が産生され続け、脳の傷害時には、新生ニューロンは傷害部位へ移動し、損傷により失われたニューロンを補うことで脳の再生に寄与します。しかし、効率的な移動に必要な足場となる細胞が少ないこともあり、十分な機能回復には至りません。当研究室では、これまでに新生ニューロンの移動を促進することで神経機能が回復することを発見し、足場となり新生ニューロンの移動をサポートするバイオマテリアルを用いた研究を行ってきました。
この論文では、内因性の足場となる細胞の機能と構造を模倣し、低侵襲で移植可能なバイオマテリアルを作成するため、脳に注入後自己集合し、柔らかいハイドロゲルを形成するバイオマテリアル[(RADA)3-(RADG)] (以下mRADA)とmRADAハイドロゲルに新生ニューロンの移動に関わる細胞接着分子N-カドヘリンの細胞外領域全体を安定的に組み込んだNcad-mRADAハイドロゲルを開発しました。Ncad-mRADAハイドロゲルは、新生仔と成体マウスにおいて、新生ニューロンの傷害部位へ移動を促進する足場として機能し、様々な傷害部位の広範な領域で再生されるニューロンを増やし、さらに新生仔マウスでは機能回復に成功しました。
今回使用したバイオマテリアルを作成する技術を用いて、他の様々な因子を安定してバイオマテリアル内に保持することが可能であり、液性の誘因因子を組み合わせることで直接接していない細胞にも作用するなどさらに効果的なバイオマテリアルを作成することが出来る可能性があり、今後様々な応用が期待されます。
私は2008年医学部の学生の時に基礎配属という授業の一環で、当ラボで研究させて頂きました。入学時から基礎研究に興味はあったものの全く経験の無かった私に、指導教官の金子先生を始め、ラボの先生方が非常に丁寧にご指導下さり、基礎研究の面白さと、基礎配属優秀賞受賞という達成感を経験させて頂くことが出来ました。このような経験から、その後臨床医としてしばらく研究から離れた後の大学院進学の際、希望させて頂いた神経発達再生医学で研究させて頂くことが出来、とてもうれしく感じました。
実際の大学院生の生活は、いろいろな意味で予想を上回るものでした。短期間の基礎配属の時と比べものにならない程、非常に深く興味深い内容に携わらせて頂きましたが、当然ながら必要な時間・労力もまた比べ物にならない程大きなもので、特に学生とは異なり臨床業務を行いながらの研究は、想像以上に困難なものでした。
特に実験手技において、モデル動物作成の際、脳梗塞のサイズやマテリアルを注入する部位などを再現性をもって行うことは困難の連続でした。また、書籍やホームページ上では一見簡単なように記載されている行動解析では、対象が生物であるが故に当然ながら思うようには行動してくれず、マウスが、一切動かない、数秒おきに隙間から逃げようとする、マナーパンツを履かせたくなるくらい頻回に記録しているカメラの真上でおもらしするなど、未明に一人その後始末をしていると動物センター内で何度も世を儚みそうになった記憶が蘇ります。
しかし、そのような苦労から得られた個々のデータがまとまって次第に形をなし、一つの帰結に向かっていく過程や、最終的に完成した論文がAcceptされた時の達成感は、他に代え難いものがありました。また、複数のデータを論文としてまとめ、Reviewerからの御指摘を組み込んで補強していく手法など、とても貴重な勉強をさせて頂きました。
最後になりますが、ご指導下さいました澤本先生、中嶋先生をはじめ神経発達再生医学の先生方、当初直属でご指導下さり、同志社大学に移動後も引き続きご指導下さった金子先生、神経内科学でご指導下さった松川先生、藤岡先生、並びに共同研究者の方々に心より感謝申し上げます。
2022 シナプスの数を調節するしくみ
Kurematsu C, Sawada M, Ohmuraya M, Tanaka M, Kuboyama K, Ogino T, Matsumoto M, Oishi H, Inada H, Ishido Y, Sakakibara Y, Nguyen HB, Thai TQ, Kohsaka S, Ohno N, Yamada MK, Asai M, Sokabe M, Nabekura J, Asano K, Tanaka M, Sawamoto K.
Synaptic pruning of murine adult-born neurons by microglia depends on phosphatidylserine.
J Exp Med 219: e20202304 (2022).
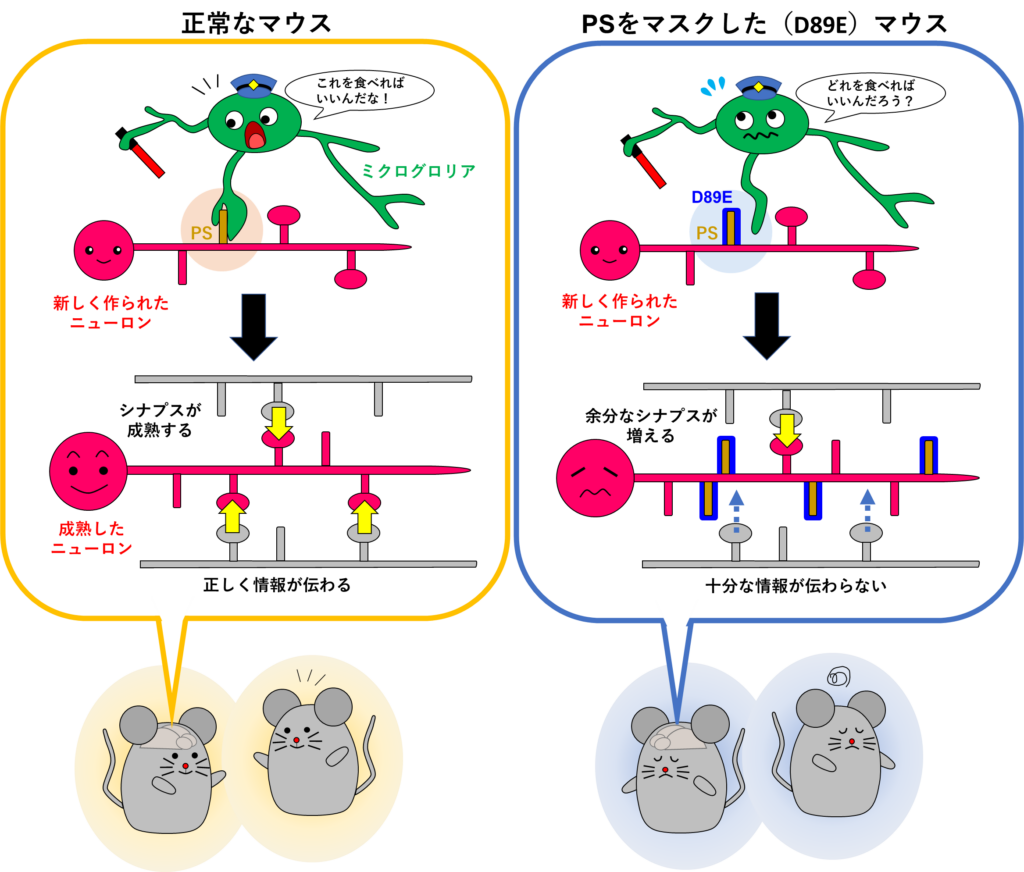
成体脳において、脳室下帯または海馬歯状回で産生された新生ニューロンは、それぞれ嗅球および海馬の神経回路へと組み込まれます。成体新生ニューロンの成熟過程において、シナプス形成機構については、様々な分子メカニズムが報告されていますが、シナプス刈り込み機構については不明な点が多く残されています。この論文では、成体新生ニューロンのシナプスの表面に露出したフォスファチジルセリン(PS)をマスクすることができる新しい遺伝子改変マウス(D89Eマウス)を作成し、ミクログリアがPS依存的に成体新生ニューロンのシナプスを貪食するということを示しました。実験を始めてしばらくして、発達期でミクログリアがPS依存的にシナプスを貪食することが示され、論文作成が急がれておりましたが、実験にご協力いただいた共同研究者の先生方に心より感謝申し上げます。
私は、2年生の春からMD-PhDコースに入り研究を始めました。研究をしっかりやってみたいという漠然とした思いはありましたが、実験ではうまくいかないことの方が多く、論文を仕上げるまでの道のりは想像以上に大変でした。特にこの論文では、初回投稿から掲載まで1年以上かかり、リビジョン期間中は大量の実験と大学の授業やテストに追われ、心が折れそうになる場面が数多くありました。しかし、そのような状況の中でも何とかやり遂げられたのは、澤本先生や澤田先生に熱心にご指導いただき、新しい発見をすることの価値や楽しさを感じることができたからだと思っております。また、最後まで粘り強く実験を続けることで人間的にも大きく成長することができ、論文作成に挑戦して本当によかったと感じています。
繰り返しになりますが、論文完成に向けてご尽力いただきました、澤本先生、澤田先生をはじめとする研究室の皆様ならびに共同研究者の先生方、誠にありがとうございました。(榑松千紘)
2022 ハビリテーションによって新生児脳傷害マウスの歩行は改善する
Yoshiaki Tsuboi, Akira Ito, Takanobu Otsuka, Hideki Murakami, Masato Sawada, Kazunobu Sawamoto
Habilitation Improves Mouse Gait Development Following Neonatal Brain Injury
Prog Rehabil Med 7:20220061 (2022)
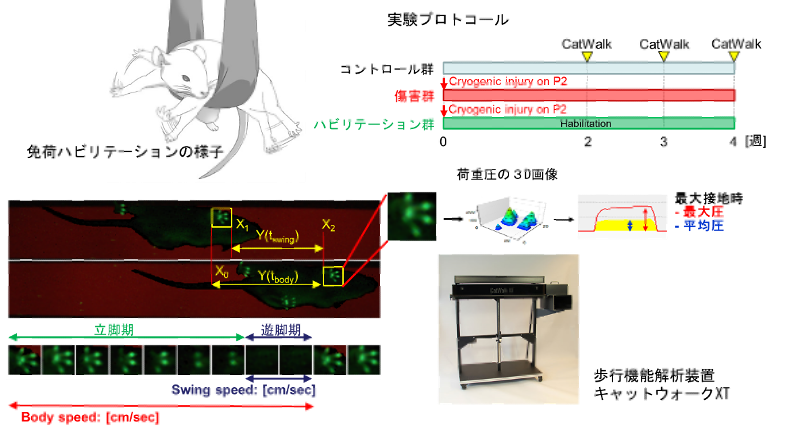
歩行発達中の新生児の脳損傷は、神経回路を混乱させ、恒久的な歩行機能障害を引き起こします。 障害のある歩行機能を改善するための介入としてのリハビリテーションは、成人に導入されます。 新生児は成人よりも優れた神経可塑性と再生能力を持っていますが、新生児の脳損傷後の歩行機能に対するハビリテーションの影響はほとんど知られていません。そこで 本研究では、新生児マウスに凍結脳損傷を作成し、その後自律的な四肢の動きを促進するためのハビリテーションを行いました。 歩行解析装置Catwalk XT システムを用いてマウスにおける歩行獲得プロセスを定量的に解析しました。その結果、マウスの通常の歩行発達では、立脚期機能が遊脚期機能よりも遅く成熟することが示されました。 また、新生児の脳損傷により歩行機能の獲得が障害されたマウスにおいて、能動的な四肢の動きを強化するハビリテーションが、歩行機能を含む運動学習を促進することを実証しました。 私たちの調査結果は、マウスの歩行発達に関する研究の基礎を提供し、周産期脳疾患によって引き起こされる歩行発達障害を持つ患者のための新しいハビリテーション戦略の可能性を提案しました。
臨床医師(整形外科)としての生活を10年ほど過ごして、漠然とこのままの医師続けて経験則や他の医師の行った研究報告の後追いで加療をしていくので良いのかという思いが沸き上がり、大学院で研究の世界をのぞいてみたい、そうすることで違う視野がもてるのではないかということで整形外科教室を通じて、澤本研を紹介いただきました。勝手のわかっていない、臨床に時間を割いている何者かわからない人間を受け入れてくださり、丁寧な指導をしていただいた澤本研の皆様には“感謝”という言葉では足らない思いであります。
特に論文作成の段階では、不出来な文章を形になる状況まで持っていっていただき、澤本研でなければ完成することなく終わっていたと思います。論文を出せたという結果そのものも貴重なことですが、それ以上に研究を行い、それを論文という形にする過程で得た経験や思考過程が当初考えていた、自分にとって「新たな視野を得る」ために重要なことであるのだと改めて思います。論文完成に向けて多大なるご迷惑をおかけし、それにも関わらずご尽力いただきました、澤本先生、澤田先生をはじめとする研究室の皆様方、並びに整形外科教室の皆様、誠にありがとうございました。(坪井 義晃)
2020 一次繊毛や微小管の共焦点・超解像ライブイメージングの手法
Sawada M, Matsumoto M, Narita K, Kumamoto N, Ugawa S, Takeda S, Sawamoto K.
In vitro time-lapse imaging of primary cilium in migrating neuroblasts.
Bio-protocol 10(22): e3823 (2020).
当時大学院生だった松本さんの一次繊毛に関する論文(Matsumoto et al., J. Neurosci, 39: 9967-9988, 2019)が発表された後、その論文で使われた一次繊毛や微小管の共焦点・超解像ライブイメージングの手法について論文にまとめることとなり、澤田がこの論文を執筆しました。
脳室下帯のdissectionや遺伝子導入、マトリゲル培養の方法は、もともと澤本先生が留学先のUCSFで習得した方法(Mirzadeh et al., J Vis Exp, 2010など)を改良したもので、これまでは先輩方のノートやクチコミを参考に引き継がれていました。この論文を執筆することで、研究室としての方法を公式にまとめることができたほか、研究室への手法の問い合わせにも論文を提示して対応することができるようになりました。私自身は、実験方法を記載する論文の執筆は経験がありませんでしたが、松本さんにもお手伝いいただき、発表することができました。なお、論文受理後に、Bio-protocolの表紙としても取り上げられました。
今後、脳室下帯のニューロン培養をする方には、ぜひご一読いただきたいと思っています。また、3次元再構築ソフトImarisの簡単な使い方についても説明していますので、ご興味があればご覧ください。
2020 コモンマーモセットの海馬神経新生と行動へのインターフェロンαの影響
Kaneko N#, Nakamura S, Sawamoto K#. (#co-correspondence)
Effects of interferon-alpha on hippocampal neurogenesis and behavior in common marmosets.
Mol Brain 13: 98 (2020).
私は山梨大学医学部付属病院の精神神経科に在籍中に大学院に進学しました。臨床でインターフェロン誘発性うつ病の患者さんの診療に当たったことをきっかけに、大学院ではインターフェロン誘発性うつ病モデルを用いた基礎研究を始めました。この研究を澤本研で更に発展させて、インターフェロンαがげっ歯類にうつ病様行動変化と神経幹細胞の増殖抑制、ニューロン新生減少を引き起こすことを報告しました(Kaneko 2006; Zheng 2014; Zheng 2015)。では、霊長類でも同じような変化が起きるか、ということに取り組んだのがこの研究です。
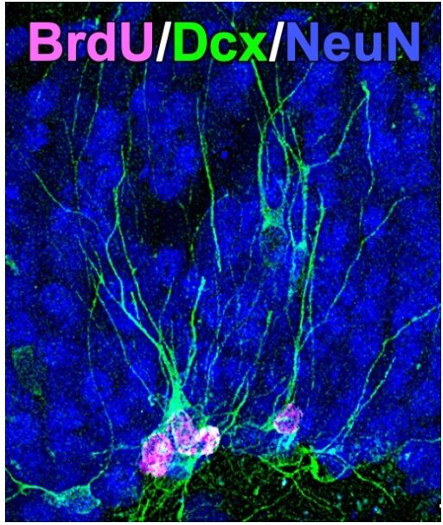
コモンマーモセット成獣に、臨床薬剤であるヒトPEG-IFNα(ポリエチレングリコールを付加した徐放化製剤)とBrdUを投与して、1ヶ月後にBrdU標識された海馬の新生ニューロン数を定量しました。また、カスタムメイドのジャケットに加速度計を入れて装着させ、活動量を持続的にモニターしました。PEG-IFNαはBrdU標識された新生ニューロン数を減少させ、また、実験開始後の活動量の回復に遅延が生じました。一方、げっ歯類脳において新生ニューロンの成熟に十分な期間である1ヶ月では、マーモセットの新生ニューロンの大部分がDcx陽性の未熟な状態のままでした。つまり、ニューロン新生の減少がこの実験で観察された行動変化の直接の原因とは考えにくい、ということです。
インターフェロンの受容体への親和性は動物種特異性が高く、マーモセットに投与したヒトPEG-IFNαの薬理作用は限定的であること、また、異種タンパクの投与によって速やかに中和抗体が誘導され、1ヶ月以上の長期投与は効果が期待できないことなど、この研究には色々な制限がありました。基礎自主研修で武田祐佳さん(2013年)、服部員長くん(2014年)にも参加してもらいました。また、中村小百合さんはこの研究の大部分に関わり、2015年に澤本先生が世話人をされた「成体脳のニューロン新生懇談会」でポスター発表しました。彼らが行った実験の一部しか論文に含めることができなかったのは心残りですが、澤本研にいる間に何とか論文として世に送り出すことができました。
2019 生後脳を移動する新生ニューロンの微細形態と一次繊毛の動態
Matsumoto M*, Sawada M*, García-González D, Herranz-Pérez V, OginoT, Nguyen HB, Thai TQ, Narita K, Kumamoto N, Ugawa S, Saito Y, Takeda S, Kaneko N, Khodosevich K, Monyer H, García-Verdugo JM, Ohno N, Sawamoto K. (*equal contribution)
[SM1] Dynamic changes in ultrastructure of the primary cilium in migrating neuroblasts in the postnatal brain.
J Neurosci 39: 9967-9988 (2019).
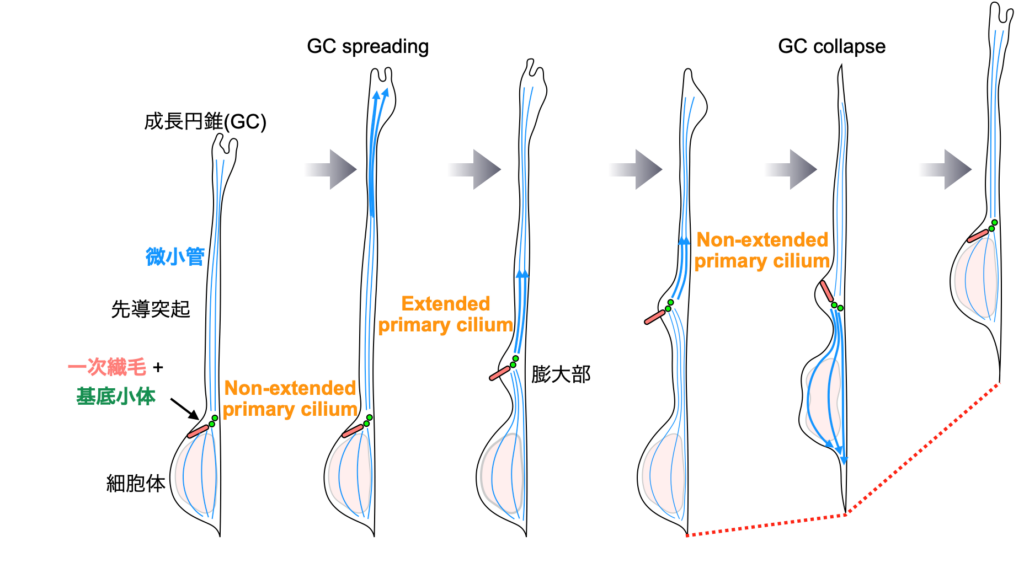
生後の脳室下帯の神経幹細胞から産生された新生ニューロンは、嗅球まで移動し、成熟します。一次繊毛はシグナルセンサーとして働いており、神経細胞の増殖や成熟への関与が報告されていました。
しかし、生後脳内を移動する新生ニューロンの一次繊毛の詳細は不明でした。そこで、この論文では、三次元電子顕微鏡などを用い、移動する新生ニューロンの一次繊毛の形態的特徴と細胞内に埋もれた一次繊毛が新生ニューロンの移動時期依存的に細胞外へ突出することを明らかにました。これらの結果から、生後脳の新生ニューロンにおける一次繊毛の時空間的な挙動変化と効率的なニューロン移動に密接な関係があることが示唆されました。

この論文は、私の博士課程の研究テーマの1つをまとめたものです。一次繊毛はその存在を明らかにすることさえ大変苦労しましたが、Verdugo研究室で習得した技術を用いて、初めて新生ニューロンに明瞭な一次繊毛を観察できた時の感動を今でも忘れられません。本論文は多くの共同研究者の方のご尽力を得て、論文にまとめることができ、無事に学位を取得することができました。特に、澤本先生には粘り強く熱心なご指導をいただきました。また、co-firstになっていただいた澤田先生には修士課程からのご指導にあわせ、実際の論文の実験・執筆など何から何までお世話になりました。末代に渡るまで澤本先生と澤田先生の方角に足を向けて寝ることはできません。澤本先生、金子先生、澤田先生を始めとするスタッフの皆様、そして同時期にラボで切磋琢磨した諸先輩方と同志の存在に感謝する一報となりました。 (松本真実)
2018 脳梗塞後の神経再生メカニズム―神経細胞の移動促進により神経機能が改善―
Kaneko N, Herranz-Pérez V, Otsuka T, Sano H, Ohno N, Omata T, Nguyen HB, Thai TQ, Nambu A, Kawaguchi Y, García-Verdugo JM, Sawamoto K.
New neurons use Slit-Robo signaling to migrate through the glial meshwork and approach a lesion for functional regeneration.
Sci Adv 4: eaav0618 (2018).
この論文の要点は以下2点です。
1)脳梗塞後の脳内で、新生ニューロンはSlit-Roboシグナルを使って活性化したアストロサイトの突起を押しのけながら梗塞巣に向かって移動するが、十分には移動できずに停止し、成熟してしまう。
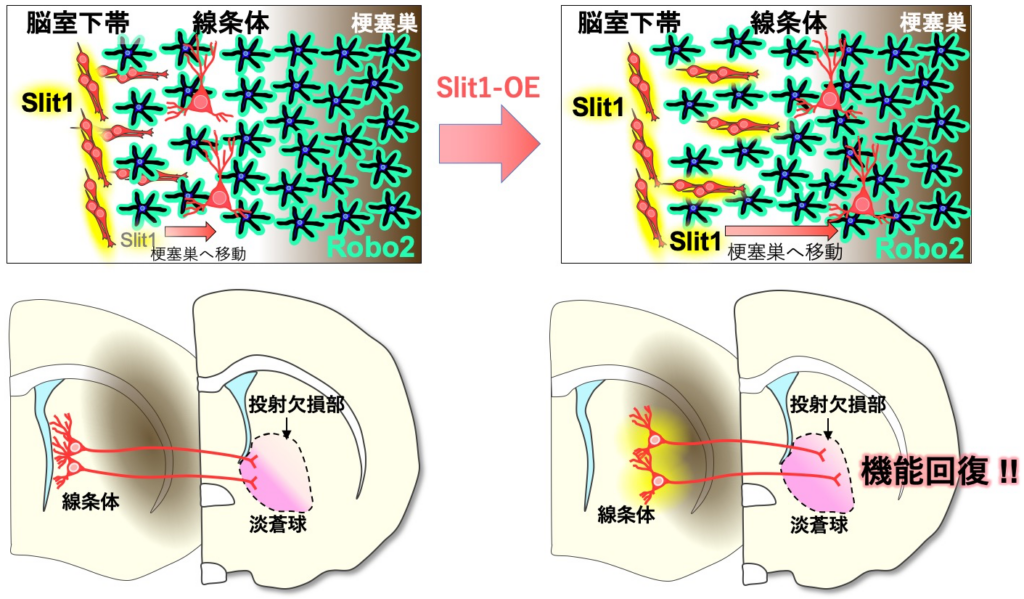
2)Slit-Roboシグナルを増強し、新生ニューロンの移動を促進して梗塞巣付近に分布させると、神経機能の回復も促進される。これまで再生効率の向上のために新生ニューロンの数を増やすことに焦点が当てられてきたが、分布位置の制御も重要であることを示唆した。
この論文の基となったデータは、RMSにおけるニューロブラストとアストロサイトの相互作用について解析して2010年にNeuron誌に掲載された論文に入る予定でした。私は博士課程の2年目から岡野研の澤本グループに所属し、4年生になるまでに論文2報の実験をほぼ終え、「プロの研究者」になる方法を模索していました。澤本先生に、グループを1年早く卒業する神経内科の山下さん、二宮さんや、脳外科の安達さんから中大脳動脈閉塞術(MCAO)を引き継ぐようにお声がけ頂いて、喜んで飛びつきました。思いのほかすんなり技術を習得し、手始めに、澤本先生が留学していた米国から持ち帰ったSlitノックアウトマウスを使って、脳梗塞後のニューロブラストの移動を解析することになりました。結構自信のあったデータだったのですが、論文が完成して共著者のArturo Alvarez-Buylla先生、Oscar Marin先生に読んで頂いたところ、お二人からMCAOのFigureは除いたほうが良いとアドバイス頂き、泣く泣く削除しました。それから苦節8年。書き切れないような苦労をしましたが、私に大型グラントと受賞とPIポジションを運んできてくれた、思い出深い論文になりました。(金子奈穂子)
2018 新生ニューロンの接着制御機構
Fujikake K*, Sawada M*, Hikita T, Seto Y, Kaneko N, Herranz-Pérez V, Dohi N, Homma N, Osaga S, Yanagawa Y, Akaike T, García-Verdugo JM, Hattori M, Sobue K, Sawamoto K. (*equal contribution)
Detachment of chain-forming new neurons by Fyn-mediated control of cell-cell adhesion in the postnatal brain.
J Neurosci 38: 4598-4609 (2018).
“麻酔科の先輩である加古先生、太田先生が在籍しているから”という軽い理由で澤本研に来た私が初めて行った実験は、287種類の阻害薬が記載されている“阻害薬リスト”を用いたスクリーニング実験でした。右も左も分からない私は何も疑うことなく実験を始めましたが、スクリーニングは当たりが出るかどうかも分からない作業。暗闇の中で小石を拾っては捨てるような作業を繰り返しました。普段は音楽を聴かない私ですが、この時はジャニーズの嵐が歌う明るい曲に励まされました。マトリゲルカルチャーが上手くできない時期に深夜の4℃部屋の中で数時間作業をしたこともあります。きっと病んでいたのだと思います。
そのような時期を乗り越えて“阻害薬リストには載っていない”Src family tyrosine kinase阻害薬に絞ることになりました。Src family tyrosine kinaseの1つであるFynにテーマが決まってからはノックダウン実験やタイムラプスイメージングなどを行い、新生ニューロンがRMSから嗅球へ移動する際に起こるchain migrationからの離脱をFynが促進していることを示すデータが集まりました。しかし、それだけでは許してくれないのが澤本研です。Fynの上流と下流シグナルを探すことになりました。上流は過去の文献などからReelin-Dab1で見当がついていたのですが、下流の接着分子は皆目見当がつかない状態でした。しかし最初に確認したN-カドヘリンが当たりという運もあり、なんとか論文化することができました。
今思い返すと暗闇で小石を拾っては捨てる作業で培った『感覚』のおかげでN-カドヘリンを選ぶことが出来たのだと思います(思いたい)。澤本先生は全てを見越した上で試練を与えて下さっていたのだと感謝しております。ありがとうございます。もちろん直接ご指導いただいた匹田先生、澤田先生にも多大なご迷惑をお掛けしました。ありがとうございました。
論文紹介のご依頼でしたが、紹介するスペースがなくなってしまいました。申し訳ございません。詳しくは論文のアブストラクトを読んでいただくか、藤掛まで問い合わせて頂けますと幸いです。
2018 放射状グリアによる神経再生機構
Jinnou H, Sawada M, Kawase K, Kaneko N, Herranz-Pérez V, Miyamoto T, Kawaue T, Miyata T, Tabata Y, Akaike T, García-Verdugo JM, Ajioka I, Saitoh S, Sawamoto K.
Radial glial fibers promote neuronal migration and functional recovery after neonatal brain injury.
Cell Stem Cell 22: 128-137 (2018).
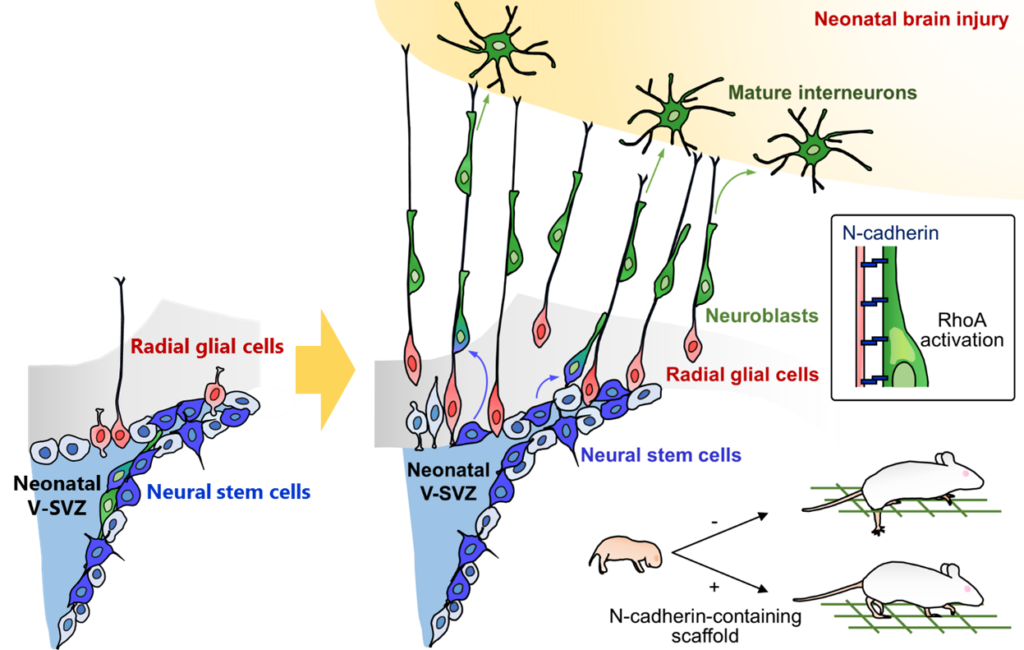
本論文では新生児期のみに備わる脳傷害後のニューロン再生メカニズムを明らかにしました。放射状グリア(Radial glia)は発生期に神経幹細胞としてニューロンを産生し、ニューロン移動の足場として機能しますが、生後すぐに消失するため、生後の機能は 不明でした。本研究ではマウスを 用いて、①新生児期では脳傷害後にradial gliaが維持されること、②新生ニューロンがradial gliaとN-cadherinを介して接着構造を形成することにより、radial glial fiberを 足場にして傷害部へ効率よく移動すること、③その際に新生ニューロンの低分子量 GタンパクRhoAが活性化されニューロン移動が促進されること、④radial glial fiberを人工的に模倣した足場を傷害脳へ移植すると、傷害部へのニューロン移動・成熟が 促進され歩行機能が回復することを示しました。
本論文では澤本研で確立された多彩な実験技術に加え、UCSFで習得したradial glia標識法、バレンシア大学との電子顕微鏡解析、味岡先生(東京医科歯科大)・田畑先生(京大)との共同研究から発展したバイオマテリアル技術がふんだんに使われており、澤本研が築き上げた財産と繋がりが結集されたものと強く感じます。また、自分が これらの共同研究に関われた縁が最終的に大きく返ってきたことも感慨深いです。

院生の時は自分のプロジェクトがどのJournalに載るか想像つかず、D3の終わりにドミネガN-cadherinのadenovirusが完成してニューロン移動が劇的に変化するのを見てようやく「どこかの雑誌には載るかな」と漠然と思った程度でした。リバイズで澤本先生・澤田さんと夜中まで行った8時間ノートチェックもよい思い出です。 最後まで諦めず頑張ったつもりですが、今でも 自分の業績と言うより皆様のお力でアクセプトして頂いたという気持ちが強いです。
本論文のおかげで多くの賞もいただき、夢であった海外留学も実現できました。私のキャリアに大きな影響を与えた貴重な論文です。
2018 ニューロンの移動停止メカニズム
Sawada M, Ohno N, Kawaguchi M, Huang S, Hikita T, Sakurai Y, Nguyen HB, Thai TQ, Ishido Y, Yoshida Y, Nakagawa H, Uemura A, Sawamoto K.
PlexinD1 signaling controls morphological changes and migration termination in newborn neurons.
EMBO J 37: e97404 (2018).
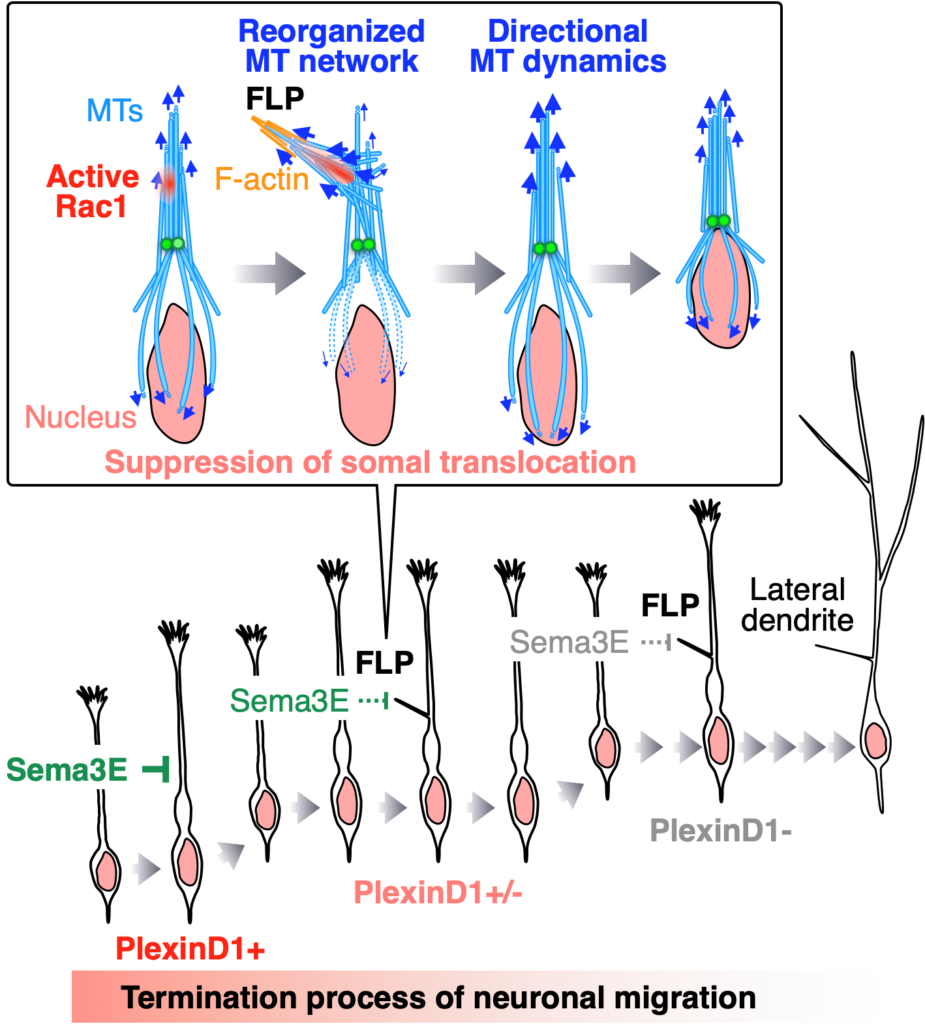
移動するニューロンは1本の先導突起を伸ばしただけの未熟な形態を示しますが、移動を停止した後は樹状突起を伸ばし、複雑な神経細胞の形態を示すようになります。しかし、ニューロンが移動を停止する過程でどのように形態を変化させるかは分かっていませんでした。本研究では、目的地で移動を停止するニューロンが形成する新しい突起filopodium-like lateral protrusion (FLP) を発見し、その調節機構としてSema3E-PlexinD1シグナルの役割を明らかにしました。
澤本先生とのディスカッションでは、一つずつの実験をどのように緻密なデータに仕上げるか、それをどのように論文として組み上げていくかを教わりました。また、発見した「新しい突起」にどのような名前をつけるか、澤本先生とたびたび議論したことはとても良い思い出です。

博士課程の後半からスタートしたこのプロジェクトは、論文受理までに7年かかりました。特に、論文のrevisionは、当時指導していた神農さんのCell Stem Cell、藤掛さんのJ Neurosciのrevisionともバッティングした上に、バレンシア大学への短期留学も迫っていたため、これまでの研究人生で最も過酷な時期でした。論文受理の吉報は、すでに渡航していたバレンシアで受け取り、追加のrevisionがなくてホッとしたのを覚えています(写真は、地元の日本人に教えていただいた、日本人経営の美味しいお寿司屋さんで、家族にお祝いしてもらった時のもの)。また、論文受理後に、EMBO Jから表紙のオファーがあったことも、とても嬉しい思い出です。
(澤田雅人)
2018 新生ニューロンが血管を足場にして移動する仕組み
Fujioka T, Kaneko N, Ajioka I, Nakaguchi K, Omata T, Ohba H, Fässler R, García-Verdugo JM, Sekiguchi K, Matsukawa N, Sawamoto K.
β1 integrin signaling promotes neuronal migration along vascular scaffolds in the post-stroke brain.
EBioMedicine 16:195-203 (2017)

脳梗塞などの脳傷害が生じると、脳室下帯におけるニューロン新生が亢進し、産生された新生ニューロンの一部は傷害部周囲へと移動して、成熟します。これらは澤本研の諸先生・先輩方が明らかにしてきた知見です。私は新生ニューロンの移動における血管の役割に注目し、新生ニューロンに発現する接着分子のβ1 integrinが、血管基底膜の主要な構成因子であるlamininとの相互作用によって新生ニューロンの傷害部への移動を促進していることを明らかにしました。

臨床教室(神経内科)から大学院生として研究室に受け入れて下さり、初めの1、2年間はマウスの交配、脳梗塞モデルの作成に苦労し、行った実験もよい結果がでませんでした。そんな状況のなか、実験を続けることができたのは、辛抱強く見守り、常にポジティブなアドバイスを下さった澤本先生、金子先生のおかげでした。苦しい時期も、時が経てばよい思い出であり、また自分が恵まれた環境で大学院生活を送れたことに感謝しています。(藤岡哲平)
2016 ゼブラフィッシュの脳室下帯の構造
Ogino T, Sawada M, Takase H, Nakai C, Herranz-Pérez V, Cebrián-Silla A, Kaneko N, Manuel García-Verdugo J, Sawamoto K.
Characterization of multiciliated ependymal cells that emerge in the neurogenic niche of the aged zebrafish brain.
J Comp Neurol 524: 2982-2992 (2016)
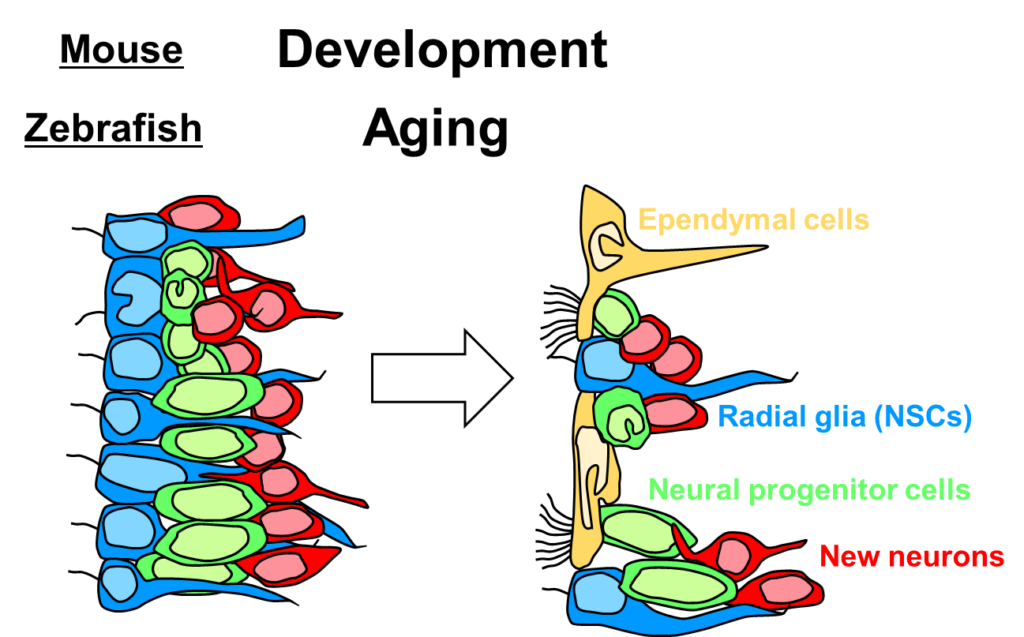
マウスを含む哺乳類では、発生期において、一時繊毛を持つ放射状グリアが脳室壁を覆っています。放射状グリアは、出生後にアストロサイト様神経幹細胞と多繊毛を持つ上衣細胞に分化します。一方、ゼブラフィッシュにおいては、成体の脳にも放射状グリアが存在しており、高いニューロン産生能が維持されています。この論文では、ゼブラフィッシュにおいて、老化に伴って、多繊毛を持つ上衣細胞が出現することを明らかにしました。このことは、放射状グリアから上衣細胞への分化という現象が、ゼブラフィッシュにおいては時期を遅らせて生じることを示唆します。

この論文は、私が修士課程2年のときに出版されたものです。実験から論文作成まで、様々な人たちの協力によってアクセプトまでたどり着きました。論文をまったく書いたことがなく、はじめて経験したことが多かったので、とても勉強になりました。最初に書いた論文ということもあり、非常に思い出深いものになっています。引き続き新たなテーマにも精力的に取り組むつもりです。(荻野崇)
2015 脳傷害後ラミニンスポンジの移植による新生ニューロン移動促進
Ajioka I*, Jinnou H*, Okada K, Sawada M, Saitoh S, Sawamoto K. (*equal contribution)
Enhancement of neuroblast migration into the injured cerebral cortex using laminin-containing porous sponge.
Tissue Eng Part A 21: 193-201 (2015).
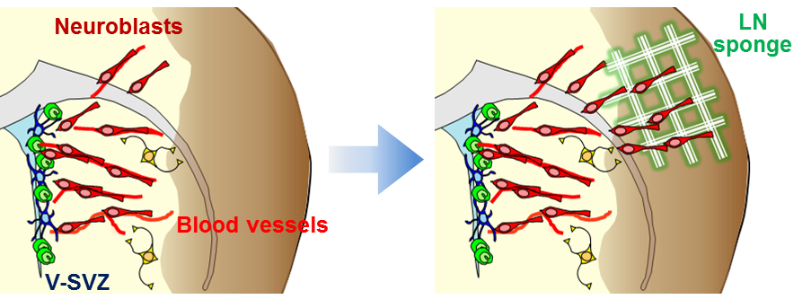
脳傷害後には、脳室下帯由来の新生ニューロンが傷害部へ血管を足場として移動します (Yamashita 2006, Kojima 2010) 。この現象から、脳傷害部へ足場血管を提供することによって、傷害部への新生ニューロン移動を誘導できるのでは、という仮説を立てました。本研究は東京医科歯科大学の味岡逸樹先生との共同研究であり、血管基底膜の主要成分であるラミニンを含有した3次元網目構造を持つスポンジを人工足場血管として味岡先生に作製していただきました (Ajioka 2011) 。このラミニンスポンジを脳傷害部へ移植したところ、新生ニューロンがラミニンスポンジを足場として移動し、炎症が増大することなく脳傷害部への新生ニューロン移動を促進することに成功しました。

博士号が授与されたとき娘からお祝いの手作りメダルをいただきました。
この共同研究の中で、味岡先生へ脳傷害モデルを教えることになったのですが、当時大学院1年生の私が、Cell に論文を出した高名な先生へ教えてよいものか…と緊張しながら行った思い出があります。味岡先生にはこの論文の後もご協力いただき、新生児脳傷害後における放射状グリア突起を足場にしたニューロン移動・再生プロジェクトにおいても、放射状グリア模倣スポンジを作製していただき、その有効性を見出す事ができました。あの時緊張しながら頑張ってよかったと思うのと同時に、複数の施設が協力し総力を結集することが、質の高い研究を遂行する上で不可欠であることを強く感じました。(神農英雄)
2014 新生ニューロンの移動時の相互足場機構
Hikita T, Ohno A, Sawada M, Ota H, Sawamoto K.
Rac1-mediated indentation of resting neurons promotes the chain migration of new neurons in the rostral migratory stream of postnatal mouse brain.
J Neurochem 128: 790-797 (2014).
成体の脳においてもニューロンは絶えず新生されている。マウスの脳において、脳室下帯(V−SVZ)で新生したニューロンはrostral migratory stream(RMS)と呼ばれる特殊な経路を通じて嗅球(OB)へと移動する。RMSにおいて新生ニューロンは鎖状の細胞塊を形成し、互いを足場として移動している。RMSは非常に高密度に細胞が存在している一方で、ここを介した細胞移動は非常に高速である事が知られている。本論文においては、RMSを移動する新生ニューロンのうち、足場となる細胞がcell autonomousに細胞体の形態を変化させる事により、移動する細胞が通る経路を作る事を明らかにしました。本研究は、in vivo = 培養細胞であった私が生物の複雑さ、面白さを再認識するきっかけとなりました。澤本先生には研究の進め方だけでなくラボの運営や申請書の作成を含め、独立した研究者として重要な物事を勉強させて頂きました。この場をお借りして御礼申し上げます。(匹田貴夫)
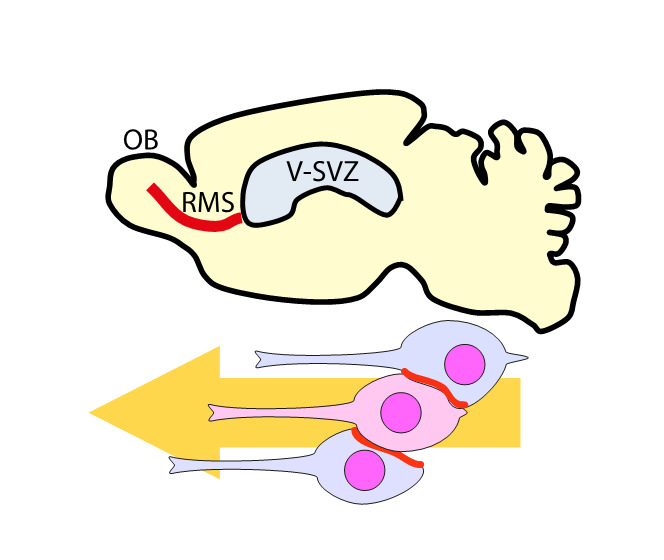
(図)成体脳内を移動するニューロン
V-SVZにおいて新生したニューロンはRMSを経てOBへと至る。RMSにおいて新生ニューロンはお互いを足場として移動する。この際に、足場となる細胞(青色)は細胞の一部を凹ませる事で後ろから来た細胞(赤色)が通るスペースを作りだす。個々の細胞形態の変化が組織内におけるスムーズな移動を可能としている。
2014 ニューロンの移動速度を調節する仕組み
Ota H*, Hikita T*, Sawada M*, Nishioka T, Matsumoto M, Komura M, Ohno A, Kamiya Y, Miyamoto T, Asai N, Enomoto A, Takahashi M, Kaibuchi K, Sobue K, Sawamoto K. (*equal contribution)
Speed control for neuronal migration in the postnatal brain by Gmip-mediated local inactivation of RhoA.
Nat Commun 5: 4532 (2014).
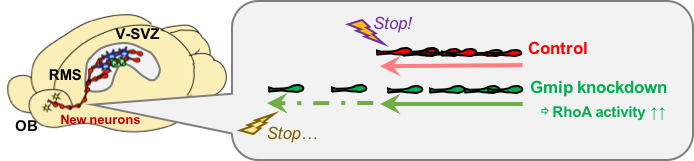
脳室下帯(V-SVZ)で新生したニューロンは、吻側移動経路(RMS)を通って脳内を移動し、嗅球(OB)で分化・成熟しますが、これらのニューロンを適切な速度で正確な位置まで移動させる細胞内分子機構については完全には解明されていませんでした。この論文ではまず、新生ニューロンの移動に必須の分子であるGirdinと相互作用する分子群の網羅的探索により、低分子量Gタンパク質RhoAの制御因子Gmipを同定しました。さらに、Gmipが細胞内での局所的なRhoA活性を抑制して新生ニューロンの移動速度を遅くし、嗅球における最終的なニューロンの定着位置決定や成熟後の樹状突起の投射パターンにも影響を与えることを示しました。これらの結果から、Gmipは細胞移動のシグナルを抑制して速度を遅くする、「ブレーキ」として働くことが示唆され、生後も継続的に新生されるニューロンが目的地に移動する際のメカニズムの一端が明らかになりました。

この研究は、博士論文のテーマとして始めました。それまで臨床医として過ごしてきた私にとっては初めての基礎研究であり、また、澤本研においては生化学的なスクリーニング手法を取り入れた初めてのテーマということもあり、匹田先生とともに試行錯誤を繰り返しました。なかなか結果が出ず、苦しい時期もありましたが、澤本先生をはじめ、スタッフの先生方の熱心なご指導と、多くの共同研究者の皆さんのご協力により、何とか世に出すことができました。完成までに5年以上を費やしましたが、最後まで諦めずに挑戦したことは、大きな自信になりました。この研究を通して学んだことを臨床に役立てることができるように、今後も精進したいと思います。(太田晴子)
2014 インターフェロンによるうつ病発症と成体ニューロン新生
Zheng LS*, Hitoshi S*, Kaneko N*#, Takao K, Miyakawa T, Tanaka Y, Xia H, Kalinke U, Kudo K, Kanba S, Ikenaka K, Sawamoto K#. (*equal contribution, #correspondence)
Mechanisms for interferon-alpha-induced depression and neural stem cell dysfunction.
Stem Cell Rep 3: 73-84 (2014).
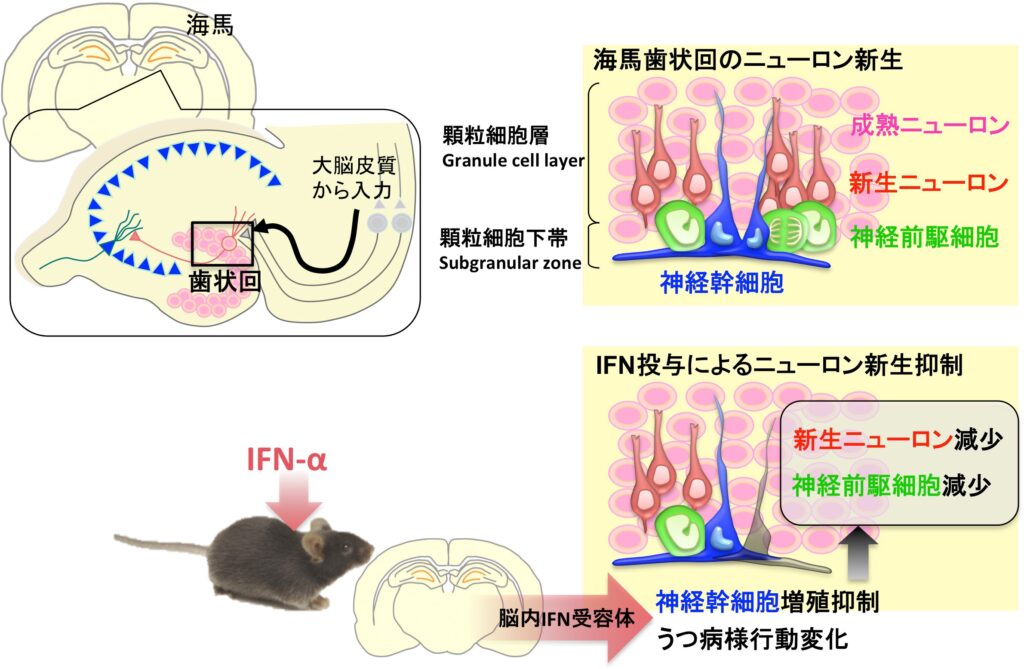
海馬は感情・情動の制御に関わり、その機能低下は様々な精神・神経疾患の病態と関連があります。海馬の歯状回という領域では、神経幹細胞が生涯にわたってニューロンを新生しています。ニューロン新生の減少が、うつ病などの精神疾患の発症や病態生理に関与する可能性が示唆されていますが、この現象の生理学的・病態生理学的意義は部分的にしか解明されていません。
炎症性サイトカインであるインターフェロン-α(IFN-α)は、慢性ウィルス性肝炎や悪性腫瘍の治療薬として用いられていますが、長期投与により高頻度にうつ病を発症します。これは治療完遂の大きな妨げとなっていますが、そのメカニズムは不明です。この研究では、長期のIFN-α全身投与によってうつ病様行動変化が生じるマウスモデルを作製して、IFN-αが中枢神経系のインターフェロン受容体を介して神経幹細胞の増殖を抑制し、うつ病様行動変化を惹起していることを明らかにし、ニューロン新生の抑制がIFN-α誘発性うつ病の発症メカニズムの一旦を担っている可能性を示しました。

この研究は、特任助教の鄭蓮順さんと一緒に行ったものです。彼女は論文投稿前に母国である中国に帰国することになり、一緒に鏡開きをすることができなかったのが心残りですが、私にとっては初めてcorresponding authorにして頂いた思い出の深い論文です。(金子奈穂子)
2012 Dishevelled2とVanglを介した新生ニューロンの配置と樹状突起形成
Hirota Y, Sawada M, Kida YS, Huang S, Yamada O, Sakaguchi M, Ogura T, Okano H, Sawamoto K
Roles of planar cell polarity signaling in maturation of neuronal precursor cells in the postnatal mouse olfactory bulb.
Stem Cells 30: 1726-1733 (2012).
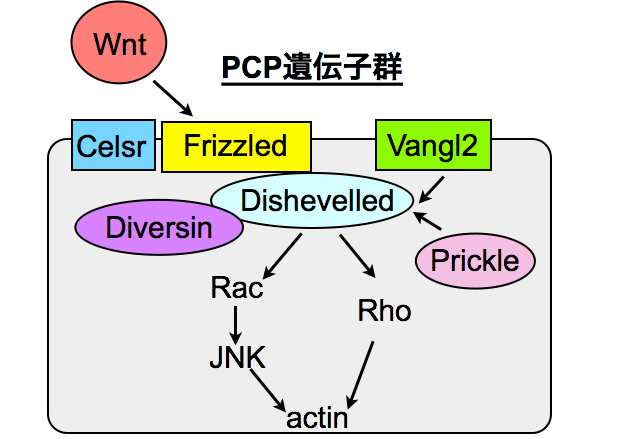
Wnt/PCPシグナルは多様な臓器で細胞極性を制御します。この論文ではPCPシグナルコア因子であるDishevelled2とVangl2がSVZで生じた新生ニューロンのOB内での配置と樹状突起形成に必要であることを報告しました。
上衣細胞でのPCPシグナルを解析していたときに、SVZニューロンでもPCPコア因子の発現があり、胎生期の神経幹細胞・神経前駆細胞でもPCPシグナルの機能が報告されていたことから着目しました。(廣田ゆき)
博士課程4年時に、転出された廣田ゆき先生の後を引き継ぎ、この論文に参加させていただきました。論文のRevisionでは、PCPシグナルが新生ニューロンの成熟過程に重要であることを示すため、樹状突起形成の解析が必要不可欠でした。当時、研究室で購入していただいたばかりの「Neurolucida」という形態解析ソフトを用いて、樹状突起の形態を解析したことをよく覚えています。樹状突起を丁寧にtraceしていくのはとても地味な作業ですが、徐々に「無」の境地になれること、定量データが一気にたくさんとれることから、私の好きなツールの1つとなっています。
結果としてこの論文は、澤本研でNeurolucidaを使用した初めての論文となりました。また、この論文参加を機に、Wntシグナルや上衣細胞発生に関与することが多くなり、私の研究の幅を広げるきっかけになった1本として、とても思い出深い論文です。(澤田雅人)
2012 嗅球のニューロン新生の細胞特異的な臨界期
Kato Y*, Kaneko N*, Sawada M*, Ito K, Arakawa S, Murakami S, Sawamoto K.
A subtype-specific critical period for neurogenesis in the postnatal development of mouse olfactory glomeruli. (*equal contribution)
PLoS ONE 7 (11): e48431 (2012).
脳室下帯の神経幹細胞によって産生された新生ニューロンは、嗅球に移動した後、顆粒細胞・傍糸球細胞の2種類の介在ニューロンに分化し、嗅球の神経回路に統合されます。これらの新生ニューロンは、様々な嗅覚機能に関与することが報告されており、嗅覚神経回路におけるニューロン新生の維持・調節の重要性が示唆されています。新生ニューロンの分化・成熟・生存は、嗅覚入力の遮断によって抑制されますが、これらの変化が入力の回復によって消失する可逆的なものであるかは分かっていませんでした。この研究では、発達期のマウスにおいて、嗅神経の入力を直接受ける傍糸球細胞に着目し、一時的な嗅覚入力障害が、その後の傍糸球細胞の新生・嗅覚機能に与える影響を解析するとともに、嗅覚刺激の治療的効果を検討し、発達期の嗅球が持つ可塑性の特徴を解析しました。
生後早期の一時的な嗅覚遮断は、特定のサブタイプの介在ニューロン(カルレチニン陽性ニューロン)の新生を持続的に抑制し、嗅覚機能障害をひき起こしました。この結果から、嗅球のニューロン新生には細胞特異的な「臨界期」が存在することが明らかになりました。一方で、これらのマウスに生じたニューロン新生抑制・嗅覚機能の障害は、長期間の嗅覚刺激によって改善することから、積極的・長期的な治療介入の有用性が示唆されました。
この論文は、澤本先生、金子先生、澤田先生をはじめ、当時の基礎自主研修の学部生であった酒井君、伊藤君、荒川君など、本当にたくさんのお力を借りて完成しました。嗅覚刺激実験中は毎日のニオイ交換が必要で、休日には家族が寝ている早朝に長い道のりを往復しました(自分なりに必死だったため、あまりよく覚えていません)。6週間かけて作成したモデルマウスが、その後の一瞬の出来事で無となる切ない日々の繰り返しを経て、成果を得られた時の感動は、今でも忘れられません。澤本研究室での経験を経て、今の自分があること、そしてたくさんの方に助けられ続けていることを忘れず、私の研究テーマであった恒常性と可塑性の精神を持って、今後の仕事に活かし続けたいと考えております。(加藤康子)
2012 虚血低酸素後の新生仔マウスの脳室下帯におけるオリゴデンドロサイト前駆細胞の産生
Kako E, Kaneko N, Aoyama M, Hida H, Takebayashi H, Ikenaka K, Asai K, Togari H, Sobue K, Sawamoto K.
Subventricular-zone derived oligodendrogenesis in injured neonatal white-matter in mice enhanced by a nonerythropoietic EPO derivative.
Stem Cells 30: 2234-2247 (2012).

周産期・未熟児医療の発展により、極低出生体重児、超低出生体重児など以前であれば長く生きられなかったであろう児も、普通の子供と同じように成長できるようになってきました。一方で、このような児は血行動態や酸素供給に破綻をきたしやすい不安定な状態で出生しており、様々な障害をきたす可能性があります。
未熟児の脳の虚血低酸素は、大脳皮質下から側脳室周囲の白質に傷害を起こすことが知られています。白質では、軸索が束になって走行しています。軸索の周囲にオリゴデンドロサイトが腕を伸ばすように巻き付いてミエリンを形成し、速やかな電気刺激の伝達(跳躍伝導)を可能にするとともに、異常な刺激の伝播を防いでいます。ミエリンの傷害は、永続的な神経学的障害を引き起こしますが、虚血低酸素による白質傷害の発症メカニズムは解明されておらず、現在まで有効な治療法は存在しません。
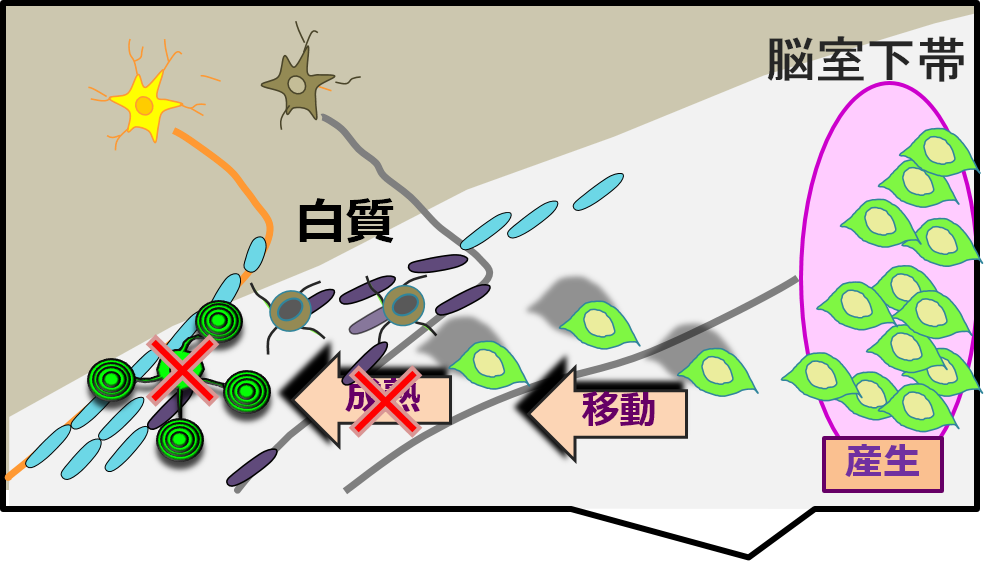
この研究では、遺伝子改変マウスやウィルスを用いた細胞標識により、虚血低酸素後の新生仔マウスの脳室下帯においてオリゴデンドロサイト前駆細胞(OPC)が産生され、傷害部へ移動するという内在性の再生機構があることを発見しました。しかし、これらのOPCはオリゴデンドロサイトへの分化・成熟に障害があり、ミエリンの再生を誘導できないことが分かりました。
造血薬として用いられているエリスロポエチンは、近年その神経保護作用が注目されています。我々は、誘導体であるアシアロエリスロポエチン(AEPO)が、OPCの成熟を促進することを見出しました。AEPOの投与によって、白質障害モデルマウスの傷害部での新生OPCの成熟が促進され、組織学的・神経学的な改善が誘導されました。AEPOは造血作用がなく、小児に対しても高い安全性を有するため、小児白質傷害の治療に応用できる可能性があります。本研究は、「再生医療の実現化プロジェクト」の一環として、学内の複数の研究室の協力のもとで行われました。(加古英介)
2011 コモンマーモセットの脳室下帯及びrostral migratory streamの構造
Sawamoto K*, Hirota Y*, Alfaro-Cervello C*, Soriano-Navarro M*, He X, Hayakawa-Yano Y, Yamada M, Hikishima K, Tabata H, Iwanami A, Nakajima K, Toyama Y, Itoh T, Alvarez-Buylla A, Garcia-Verdugo JM, Okano H. (*equal contribution)
Cellular composition and organization of the subventricular zone and rostral migratory stream in the adult and neonatal common marmoset brain.
J Comp Neurol 519:690-713 (2011).
霊長類であるコモンマーモセットの脳室下帯を電子顕微鏡と光学顕微鏡で解析したものです。当時脳室下帯の構造は、マウスで良く解析されていましたが、霊長類では十分に研究されておりませんでした。マーモセットの脳室下帯は、マウスとヒトに共通した特徴を示すことがわかりました。
これは、2003年にUCSFから帰国後、慶應義塾大学医学部生理学教室(岡野栄之教授)で始めた研究で、電顕による解析はバレンシア大学のGarcia-Verdugo教授(co-corresponding author)のグループによって行われました。論文作成に時間がかかりましたが、名古屋市立大学へ異動してから廣田ゆきさん(当時助教)にご協力いただき、共筆頭著者4名の論文として発表しました。私が筆頭著者として発表する最後の原著論文になりそうです。(澤本和延)

2011 嗅覚入力によるニューロン再生促進
Sawada M, Kaneko N, Inada H, Wake H, Kato Y, Yanagawa Y, Kobayashi K, Nemoto T, Nabekura J, Sawamoto K.
Sensory input regulates spatial and subtype-specific patterns of neuronal turnover in the adult olfactory bulb.

J Neurosci 31:11587-11596 (2011).
成体脳において、脳室下帯で産生された新生ニューロンは、匂いの情報を処理する嗅球へと移動して神経回路へと組み込まれます。一方で、古い嗅球ニューロンは常に細胞死によって除去されており、嗅球ではニューロンが入れ替わることで嗅覚機能を維持すると考えられています。しかし、神経回路が完成した成体脳において、古いニューロンが新しいニューロンと入れ替わるしくみは分かっていませんでした。
本研究では、生きたまま脳の中のニューロンを観察することができる「2光子レーザー顕微鏡」を用いて、細胞死を起こした嗅球ニューロンの場所に、同じ種類の新生ニューロンが再生することを明らかにしました。さらに、この同じ場所でのニューロン再生は嗅覚入力によって促進されることが分かりました。本論文で明らかにした結果は、成体脳において脳の構造を維持しつつ、感覚入力依存的にニューロンを活発に入れ替える効率的なメカニズムが存在することを示唆しています。

澤本研が名古屋市立大学にラボを構え、金子奈穂子先生や耳鼻科の加藤康子さんらが新たにスタートさせた嗅球プロジェクトに、大学院博士課程の学生として参加させていただきました。2光子顕微鏡の実験は生理学研究所・鍋倉淳一研究室へ通い詰めて立ち上げました。In vivoライブイメージングに夢中になり、データをまとめて意気揚々と論文投稿までこぎつけたのは良かったのですが、そこからはsubmission→rejectionの繰り返し…。J Neurosciにacceptされた時には、嬉しいというよりはホッとしたのを覚えています。澤本先生、金子先生に粘り強くご指導いただき、科学の世界で自分の結果を認めてもらうことの厳しさを、身をもって体験した一本です。(澤田雅人)
2010 上衣細胞の繊毛の形成機構
Hirota Y, Meunier A, Huang S, Shimozawa T, Yamada O, Kida YS, Inoue M, Ito T, Kato H, Sakaguchi M, Sunabori T, Nakaya MA, Nonaka S, Ogura T, Higuchi H, Okano H, Spassky N, Sawamoto K.
Planar polarity of multiciliated ependymal cells involves the anterior migration of basal bodies regulated by non-muscle myosin II.
Development 137:3037-3046 (2010).
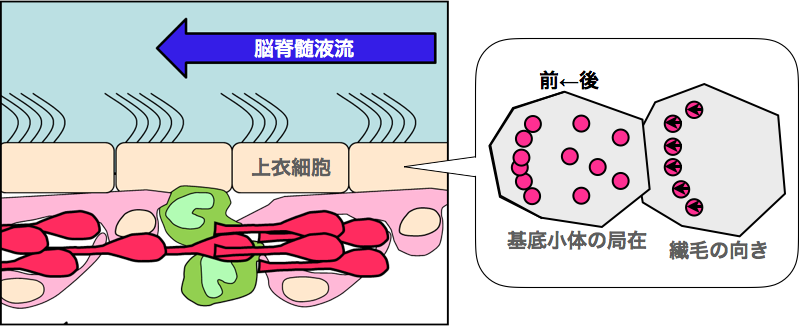
多数繊毛を持つ上衣細胞は繊毛の運動方向に示される極性と、繊毛の局在位置に示される極性の2種類の平面極性を持っています。この論文では後者の形成過程において、繊毛の基部が細胞のアピカル面を移動することと、その際に非筋細胞ミオシンIIが必要であることを報告しました。
数十ヘルツで往復運動する繊毛の観察ではついうっとりと見入ってしまい時間を浪費していました。いつかまた繊毛の研究をしたいです。(廣田ゆき)
コラム ー澤本研の飲み会ー
澤本先生のScienceで初登場して以来10年間余り、原著論文が受理された際の「鏡開き」は澤本研の欠かせない行事になっています。最近では、鏡開きのお酒を飲むと論文が通りやすくなるという都市伝説まで流れ、博士課程高学年の学生やスタッフが我こそ先にと飲む姿も見受けられます。
澤本研の飲み会スタイルも10年間で変遷を遂げていきました。初期は飲み屋さんを予約して開催する一般的なスタイルでしたが、日頃黙々と実験しているメンバーが飲み会の時に弾ける事態が頻発し、徐々に「世間の人様に迷惑をかけない」ラボの中での飲み会へと変わっていきました。今では、焼きそば、お好み焼きはもちろん、流し素麺、餃子、パエリヤなどバリエーションも増え、料理のできるラボへと様変わりしています。ただ、飲んで弾ける人はラボの中でも出るもので…これからも楽しく飲めれば良いですね。(澤田雅人)
2010 Wntシグナルの新規構成因子Diversinの発現
Ikeda M, Hirota Y, Sakaguchi M, Yamada O, Kida YS, Ogura T, Otsuka T, Okano H, Sawamoto K.
Expression and proliferation-promoting role of Diversin in the neuronally committed precursor cells migrating in the adult mouse brain.
Stem Cells 28:2017-2026 (2010).
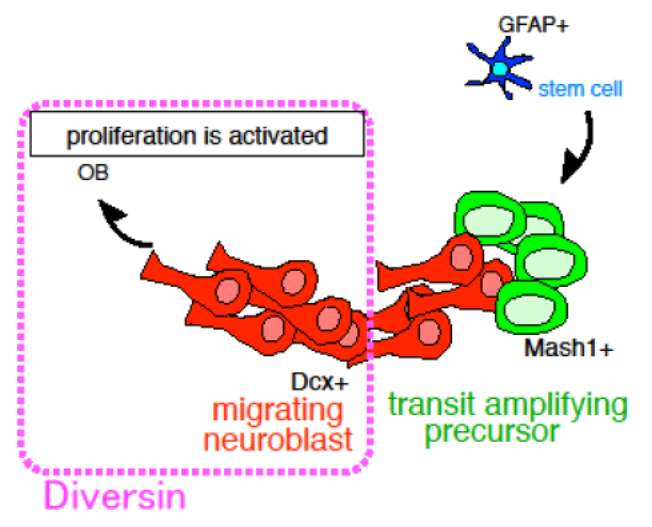
脳梗塞などの脳損傷モデルにおいて脳室下帯に存在する神経幹細胞から新しいニューロンが供給されることが報告され、損傷した中枢神経系組織の修復に内在性の神経幹細胞が利用できるのではないかと期待されています。本研究ではWntシグナルの新規構成因子Diversinに着目し、Diversinが成体と幼若期の脳において脳室下帯の新生ニューロンと嗅球の成熟ニューロンに発現している事を明らかにしました。さらに、脳室下帯へレトロウィルスを用いて遺伝子を導入し、Diversinの過剰発現が新生ニューロンの増殖を促進する事を明らかにしました。RNA干渉法を用いたDiversinのノックダウンによって新生ニューロンの増殖が抑制された事から、Diversinは新生ニューロンの増殖に重要な生理的機能を果たしていると結論づけられ、不明であった新生ニューロンの増殖制御機構の一端が解明されました。
この研究は、生まれて半年余りの娘をかかえ、大学院に入学して何もわからない中で始めました。ラボ自体も名市大に移ったばかりでしたし、うまくいかない事ばかりでした。でも、周りの先生方、大学院生の仲間がとても親切で優秀な方ばかりだったので、支えられながら、私も娘も大いに刺激をうけて成長した4年間でした。「少しずつでも努力して、少しずつでも人のためになれるように心がける」それが、ラボで学んだ一番大切なことでした。あれから6年がたとうとしていますが、娘にとってはラボで出会った方々は今でも憧れらしく『ラボの顕微鏡ならプランクトンって見られるのかな?○○さんどうしてるかな?○○さんみたいにどうしたらなれるの?』などと、思い出しては話をしており、この研究で娘にまかれた未来の種が大きく育ってくれたらなと思っています。(池田麻記子)
2010 新生ニューロンのアストロサイトトンネル形成・維持機構
Kaneko N, Marin O, Koike M, Hirota Y, Uchiyama Y, Wu JY, Lu Q, Tessier-Lavigne M, Alvarez-Buylla A, Okano H, Rubenstein JL, Sawamoto K.
New neurons clear the path of astrocytic processes for their rapid migration in the adult brain.
Neuron 67:213-223 (2010).
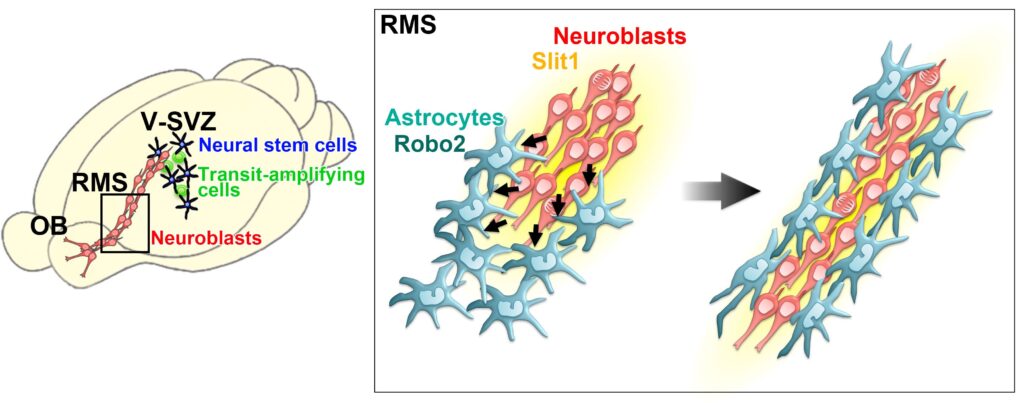
脳室下帯(V−SVZ)から嗅球(OB)への新生ニューロンの移動経路であるRMSは、新生ニューロン(Neuroblast)の鎖状細胞塊はアストロサイト(Astrocyte)が形成するトンネルによって覆われています。このトンネルは、新生ニューロンのスムーズな移動に寄与していると考えられていますが、その形成・維持メカニズムは分かっていませんでした。この論文では、RMSを移動する新生ニューロンが忌避性のガイダンス因子として知られるSlit1を分泌し、その受容体であるRobo2を介して周囲のアストロサイトの分布や形態を制御してトンネル形成を誘導し、自身の移動経路を形成・維持していることを明らかにしました。

この研究は、私が「学位取得後も臨床医に戻らず研究者になりたい」と決意したブリヂストン寄附講座時代に始めたもので、人生の重要な転機となったため、とても思い出深いものです。落ちこぼれ院生だった私は、実験手技や関連論文の勉強など本当に細かいことから先生にご指導頂き、そしてノックアウトマウスと一緒に名古屋市大に引っ越して苦節4年、ようやくこの論文がアクセプトされました。
このSlit-Roboシグナルを介した新生ニューロンとアストロサイトの関係は、脳梗塞巣への新生ニューロンの移動にも関与しており、これは私の現在の重要な研究課題のひとつです。(金子奈穂子)
2007 Wnt-β-cateninシグナルの神経新生への寄与
Adachi K, Mirzadeh Z, Sakaguchi M, Yamashita T, Nikolcheva T, Gotoh Y, Peltz G, Gong L, Kawase T, Alvarez-Buylla A, Okano H, Sawamoto K.
Beta-catenin signaling promotes proliferation of progenitor cells in the adult mouse subventricular zone.
Stem Cells 25:2827-2836 (2007).
神経再生のアプローチ方法は、脳室下帯から嗅球におけるニューロン新生機構の存在が解明されてきたことにより、神経幹細胞の移植といった方法だけではなく、内在性神経幹細胞を誘導することにより損傷脳の再生を試みるといった方法が考えられてきました。
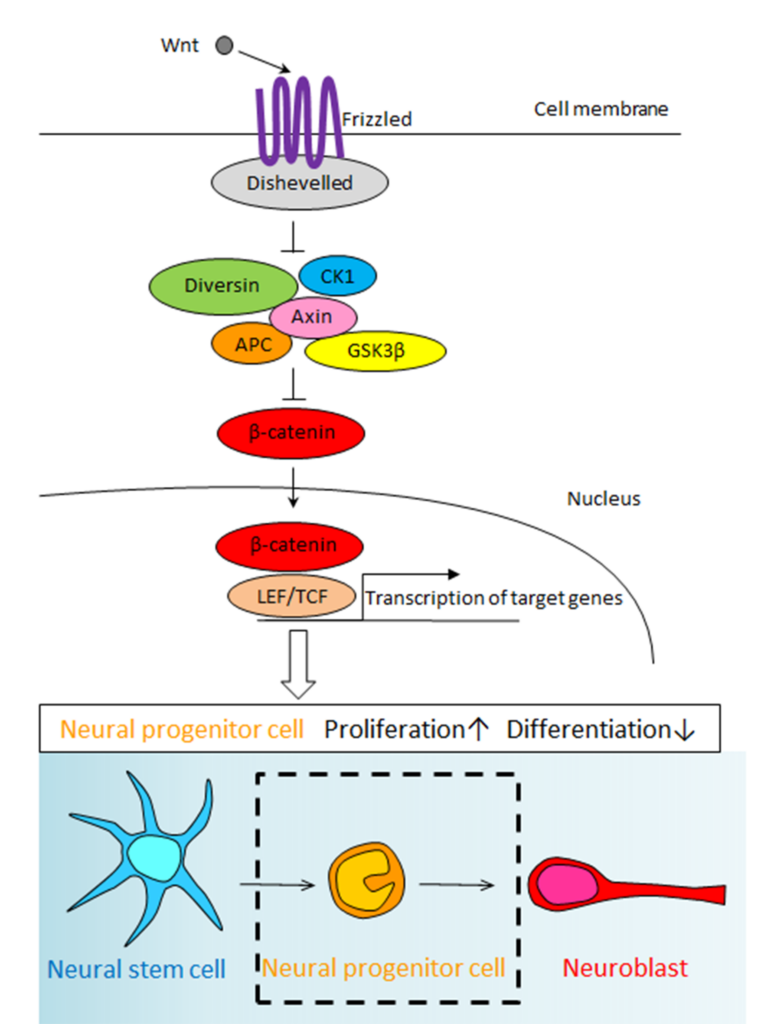
脳室下帯には、type B cellと呼ばれる神経幹細胞が存在します。type B cellは増殖能が高い中間的な前駆細胞であるtype C cellへと分化し、type A cellと呼ばれる移動能の高い幼若な新生ニューロンを産生しています。新生ニューロンは、嗅球まで移動して、成熟ニューロンに分化します。
この論文では、薬理学的手法やウイルスによる遺伝子発現制御技術を用いることによって、神経発生の様々な段階に関与することが知られているWnt-β-cateninシグナルがtype C cellの増殖に寄与し、その結果嗅球で成熟する新生ニューロンが増加することを明らかにしました。(安達一英・荻野崇)
現在は臨床を中心に仕事をさせていただいておりますが、大学院時代に行わせていただいたこの研究は、現在でも臨床研究を立案し評価するうえで大切となる、基礎的評価並びに考察力をつけることができた、有意義な時間であったと考えております。(安達一英)
2007 Cdk5の新生ニューロン移動における役割
Hirota Y, Ohshima T, Kaneko N, Ikeda M, Iwasato T, Kulkarni AB, Mikoshiba K, Okano H, Sawamoto K.
Cyclin-dependent kinase 5 is required for control of neuroblast migration in the postnatal subventricular zone.
J Neurosci 27:12829-12838 (2007).
Cdk5は中枢神経系に広範に発現するリン酸化酵素であり細胞骨格の制御など多数の機能を持っています。この論文ではノックアウトマウスを用いた解析により、Cdk5はSVZ-RMS-OBを移動するニューロンにおいて鎖状構造の形成、移動スピード、方向性、先導突起形成に必要であることを明らかにしました。
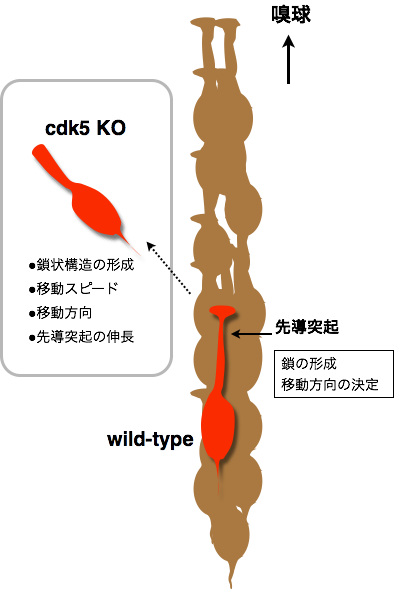
リビジョンとラボの引っ越しが重なりましたが、多くの方々のご協力により滞りなく実験が進められました。(廣田ゆき)

コラム ー澤本研におけるスライス培養の歴史ー
澤本研のスライス培養・タイムラプス撮像実験の歴史は、この論文(Hirota et al, J Neurosci, 2007)から始まりました。廣田さんは試行錯誤を繰り返し、大変な苦労をして画像を取得して解析をしていました。この頃は、スライスした脳をメンブレンフィルター上で培養し、LSM Pascalでタイムラプス撮像を行っていました。この方法では、解像度や検出能に限界があったため用途は限られていましたが、脳内を動く細胞を観察できるようになったことで、私達の研究は飛躍的に発展しました。
その後、2009年に購入したLSM710に高機能検出器を搭載し、更に灌流培養システムを導入するに至り、成体・傷害脳・微細構造など観察対象がどんどん広がっていき、現在に至ります。(金子奈穂子)
2006 新生ニューロンの生存におけるアセチルコリンの役割
Role of the cholinergic system in regulating survival of newborn neurons in the adult mouse dentate gyrus and olfactory bulb.
Genes Cells 11:1145-1159 (2006).
成体内でも持続的に産生されている幼若なニューロンは、海馬・嗅球で成熟する過程で半数以上が淘汰され、一部の細胞のみが成熟ニューロンとして神経回路に編入されます。よって、神経幹細胞・前駆細胞の増殖だけでなく、新生ニューロンの生存の制御もニューロン新生の活性を変化させる重要なファクターです。
アルツハイマー病モデル動物や患者脳では、ニューロン新生に様々な異常が現れます。アルツハイマー病の治療薬として用いられているアセチルコリンエステラーゼ(AChE)阻害薬(donepezil)は、アセチルコリンの分解を阻害してコリン作動性の神経伝達を増強するとともに、ニ
ューロンを保護する作用がありますが、ニューロン新生への作用は知られていませんでした。この研究では、成体マウスの海馬歯状回や嗅球に存在する新生ニューロンが、複数のサブ
タイプのアセチルコリン受容体を発現していること、また、AChE阻害薬を長期投与すると、歯状回や脳室下帯における神経幹細胞・前駆細胞の増殖には変化を与えずに、新生ニューロンの生存を促進することにより新生ニューロンを増加させていることを見いだしました。

山梨大学で精神神経科の臨床医をしていた私は、岡野研という日本最大規模の基礎研究室でのカルチャーショックは大きく、完全に落ちこぼれ院生でした。それでも、配属された「澤本グループ」で、先生や先輩方・仲間たちに助けて頂き、グループの恒例行事になったばかりだった“アクセプト記念鏡開き”をすることができました。この満面の笑み・・・岡野研で過ごした大学院生時代は、とても楽しかった思い出とともに、今も私を支えてくれています。(金子奈穂子)
2006 脳梗塞後のニューロン新生と虚血部への移動
Yamashita T*, Ninomiya M*, Hernandez Acosta P, Garcia-Verdugo JM, Sunabori T, Sakaguchi M, Adachi K, Kojima T, Hirota Y, Kawase T, Araki N, Abe K, Okano H, Sawamoto K (*equal contribution).
Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum.
J Neurosci 26:6627-6636 (2006).
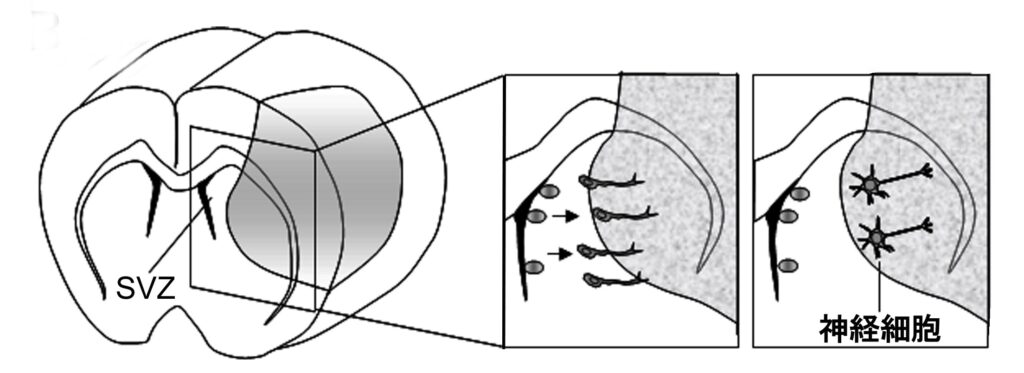
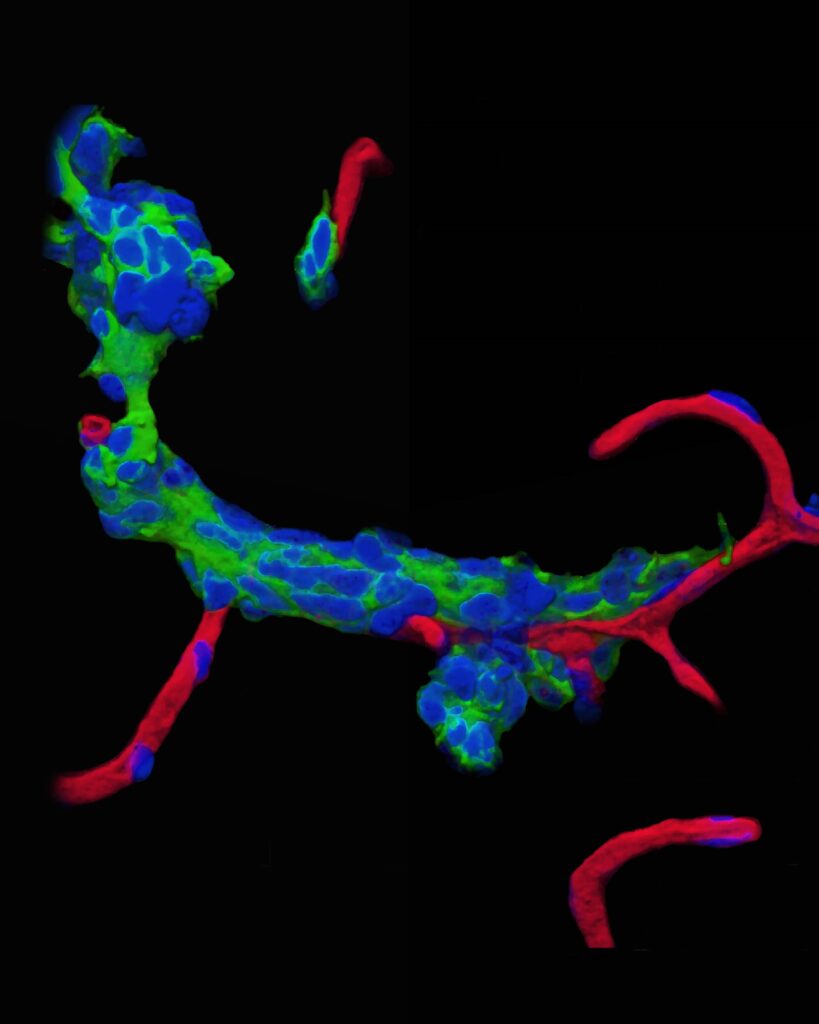

マウス脳梗塞モデルを用いて、脳梗塞後に側脳室下層の神経幹細胞、神経前駆細胞が増殖し、その一部が虚血巣へ遊走し、成熟ニューロンとなることを明らかにした論文です(上図左)。また、この虚血巣へ遊走する際に神経前駆細胞(緑)が脳内の血管(赤)を足場として遊走することを明らかにしました(上図右)。苦労話は尽きませんが、マウス脳梗塞の長期生存モデルの作成自体が困難の連続でした。当時脳梗塞動物モデルはラットが主流で、マウスで脳梗塞モデルを作成したとしても5日以内に評価することが多かったのですが、この実験のためには脳梗塞作成後28日以上長期生存モデルを作成する必要がありました。しかしながら、実験を始めた当初は脳梗塞が作成できたと思っても多くのマウスが術後6-7日目で死亡することが相次いで起こり、実験を始めて約2か月目で澤本先生にこの長期生存モデルの樹立自体が不可能なのではないかと相談に乗ってもらった記憶があります。結局は手術手技自体の向上や血管クリップの工夫等で生存率が大幅に改善し、実験を継続することが出来ました。
現在この論文の引用回数は2006年に掲載されて以降10年間で400回を超えてきており、様々な総説にも引用される論文となりました。またこの論文のおかげで2009年からのニューヨークのコロンビア大学に海外留学する際も採用にこぎつけることができました。様々な意味で私の人生を変えるターニングポイントとなった論文だと思っています。(山下徹)
Kaneko N, Okano H, Sawamoto K
2006 脳脊髄液流が新生ニューロンの移動方向に与える影響
New neurons follow the flow of cerebrospinal fluid in the adult brain.
Sawamoto K, Wichterle H, Gonzalez-Perez O, Cholfin JA, Yamada M, Spassky N, Murcia NS, Garcia-Verdugo JM, Marin O, Rubenstein JL, Tessier-Lavigne M, Okano H, Alvarez-Buylla A.
Science 311:629-632 (2006).
私は、2001年3月から2003年1月までの間カリフォルニア大学サンフランシスコ校のArturo Alvarez-Buylla教授の研究室にポスドクとして参加しました。この研究室は、adult neurogenesisに関する重要な論文を多数発表していましたが、渡米前から私が特に興味を持っていたのは、幹細胞から生まれた新生ニューロンが鎖状の塊(chain)を形成し、それが成体マウスの脳室壁に沿って美しいネットワークを作りながら動いているという発見です。この鎖状のネットワークパターンは、成体脳でも再生できることから、脳内の何らかの情報が細胞の移動方向を決定していると思われていました。この論文では、このニューロンの移動方向が、上衣細胞の繊毛運動と、それによって制御される脳脊髄液流と一致していることを示し、脳脊髄液流が反発性シグナル分子の脳内における分布をコントロールして、細胞の移動方向に影響を与えることを提唱しました。
UCSFでの実験期間は2年足らずでしたが、帰国してから論文を作成し、掲載されるまでさらに3年間もかかってしまいました。辛抱強く応援して下さった慶應義塾大学の岡野教授、ブリヂストン寄附講座の皆さんに感謝しております。(澤本和延)

UCSF最後の日、送別会のあとで
右端より、Arturo Alvarez-Buylla教授、Kazunobu Sawamoto



