研究室概要
澤本研究室では、中枢神経系の発生・再生のメカニズム解明と再生医療への応用をめざして、成体脳における神経幹細胞の増殖・分化と新生神経細胞の移動・成熟機構を中心に、齧歯類と霊長類、正常動物と疾患モデルを比較しながら研究しています。澤本研究室に少しでも興味のある方は、是非研究室見学に来てください!お待ちしております。
名古屋市立大学大学院医学研究科
脳神経科学研究所 神経発達・再生医学分野
〒467-8601 愛知県名古屋市瑞穂区瑞穂町字川澄1
Phone (052) 853-8532
Fax (052) 851-1898
Department of Developmental and Regenerative Neurobiology,
Institute of Brain Science,
Nagoya City University Graduate School of Medical Sciences
Kawasumi 1, Mizuho-cho, Mizuho-ku, Nagoya 467-8601, Japan
Phone +81-52-853-8532
Fax +81-52-851-1898
筆頭著者による研究内容の解説
-
2025
成長円錐のライブイメージングおよび光操作に関する手法
-
2025
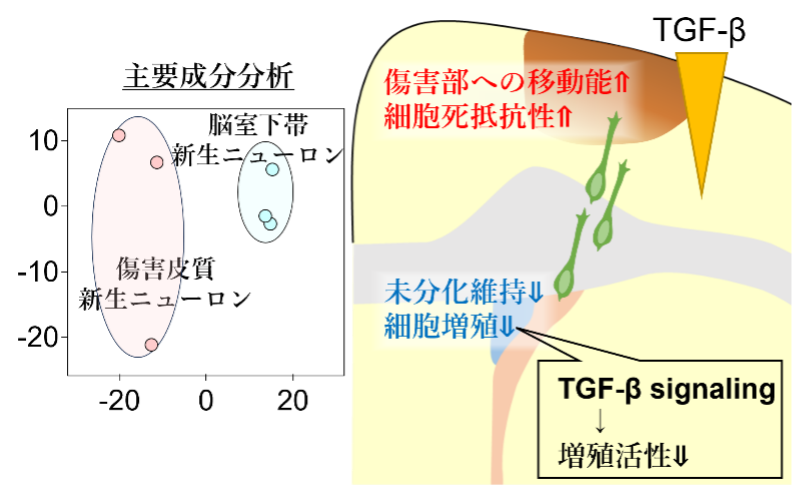
傷害部へ向かって移動する新生ニューロンのトランスクリプトーム解析
-
2025
.png)
神経幹細胞の維持における出生の意義
-
2024
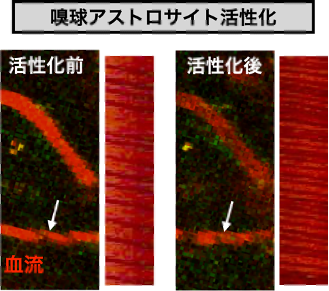
嗅球におけるアストロサイト活性化は血流増加を引き起こす
-
2024
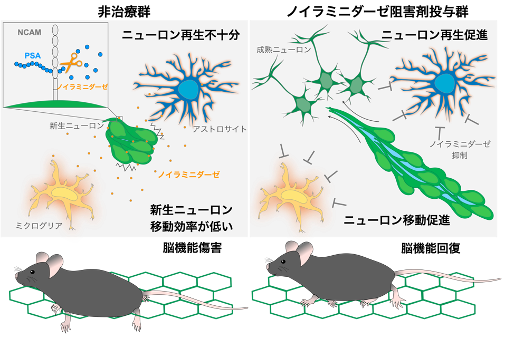
正常脳内と傷害脳内における新生ニューロンの移動メカニズムの解明および脳傷害を再生させる新規治療法の開発
-
2024
図1.png)
新生ニューロン移動における血流の役割
-
2024

新生ニューロンの成長円錐を同定―傷害脳における新たな移動促進機構―
-
2023

脳傷害後の神経再生を促す超分子バイオマテリアル
-
2022
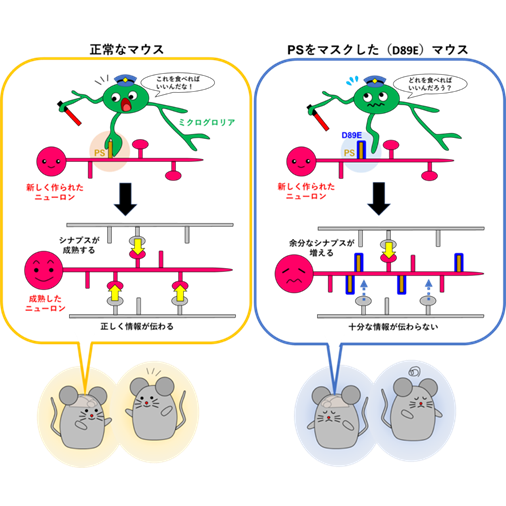
シナプスの数を調節するしくみ
-
2022
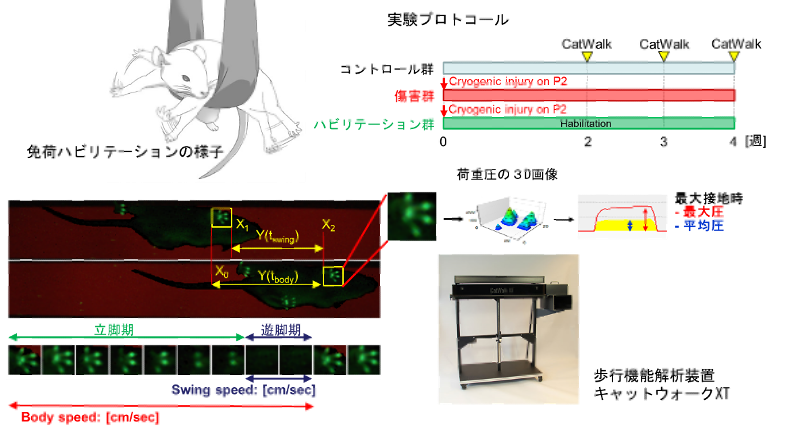
ハビリテーションによって新生児脳傷害マウスの歩行は改善する
-
2020

一次繊毛や微小管の共焦点・超解像ライブイメージングの手法
-
2020

コモンマーモセットの海馬神経新生と行動へのインターフェロンαの影響
-
2019

生後脳を移動する新生ニューロンの微細形態と一次繊毛の動態
-
2018
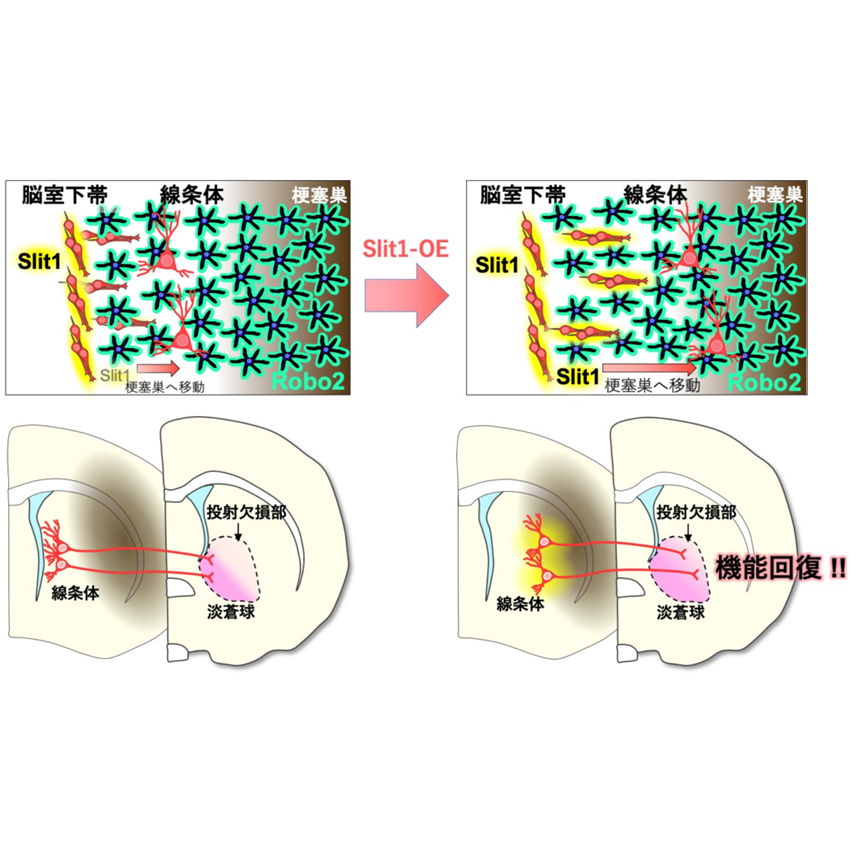
脳梗塞後の神経再生メカニズム―神経細胞の移動促進により神経機能が改善―
-
2018

新生ニューロンの接着制御機構
-
2018
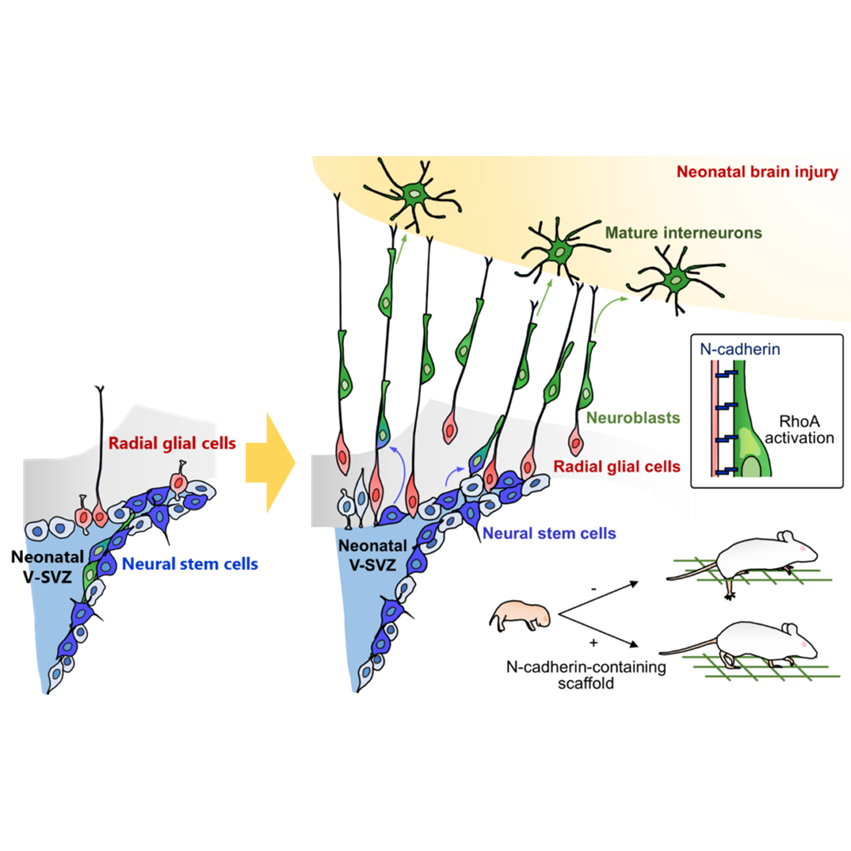
放射状グリアによる神経再生機構
-
2018
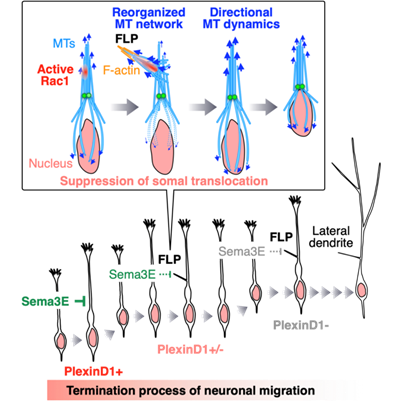
ニューロンの移動停止メカニズム
-
2018
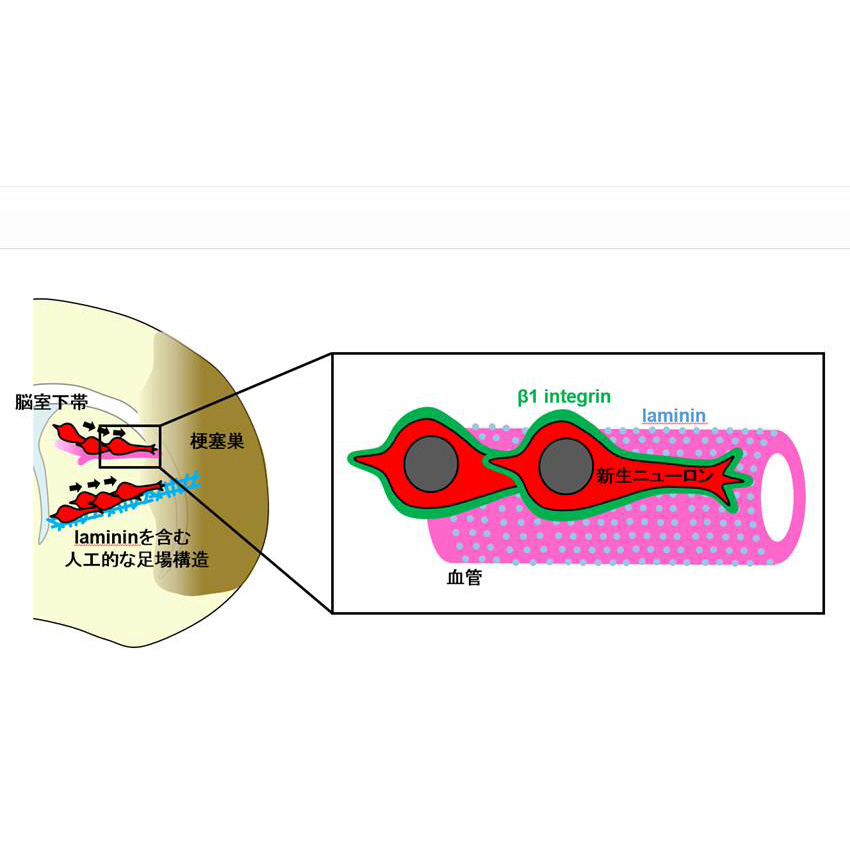
新生ニューロンが血管を足場にして移動する仕組み
-
2016
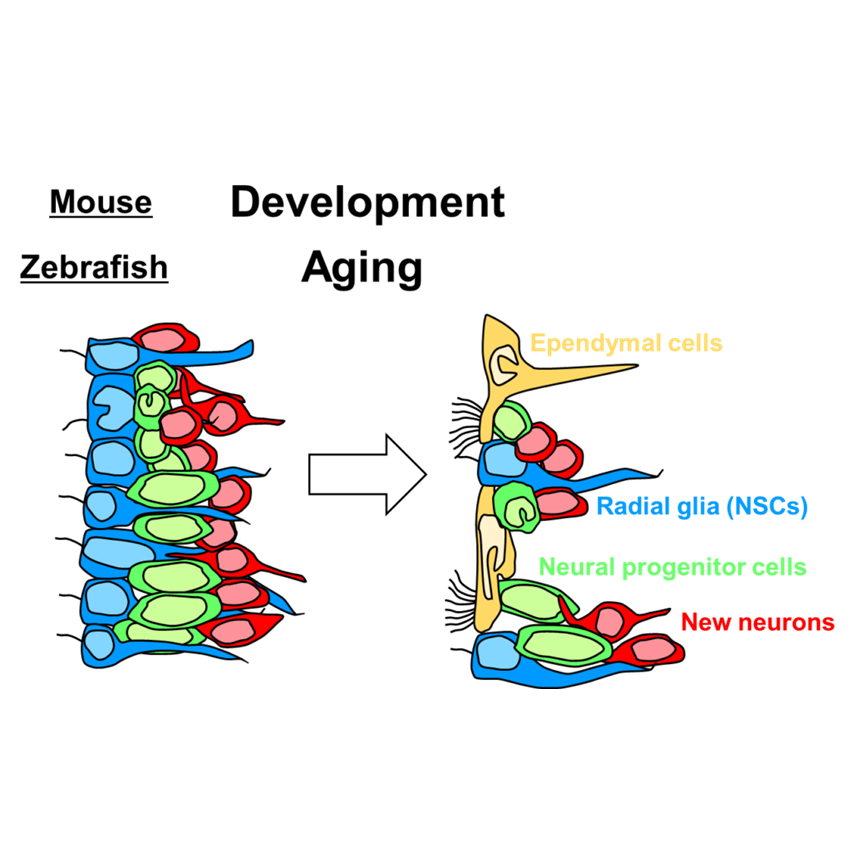
ゼブラフィッシュの脳室下帯の構造
-
2015
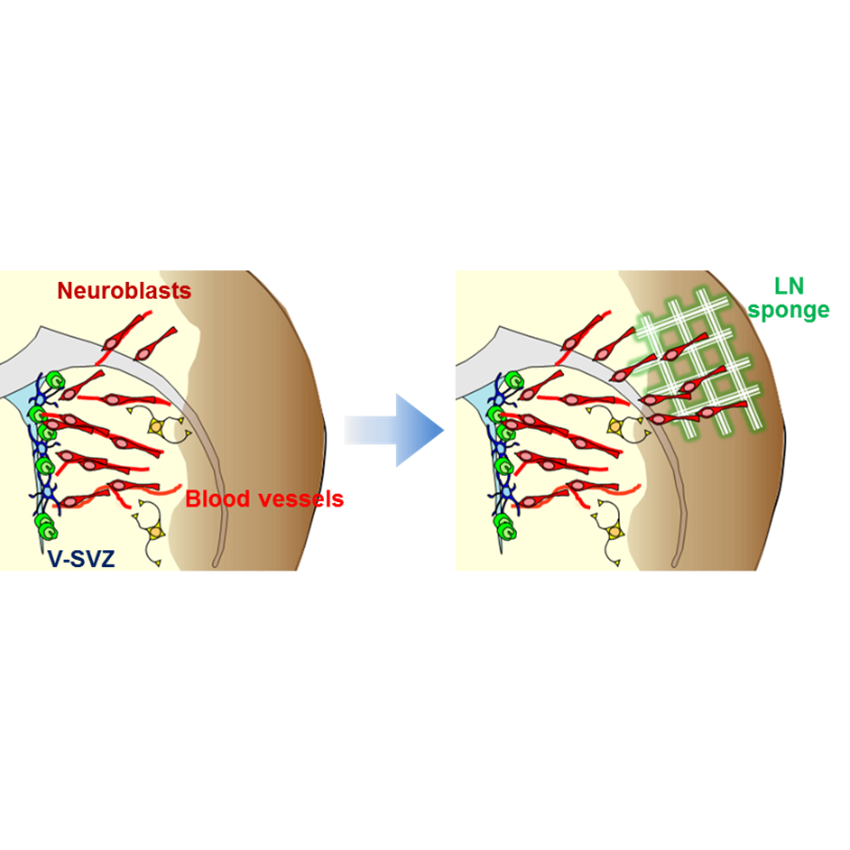
脳傷害後ラミニンスポンジの移植による新生ニューロン移動促進
-
2014
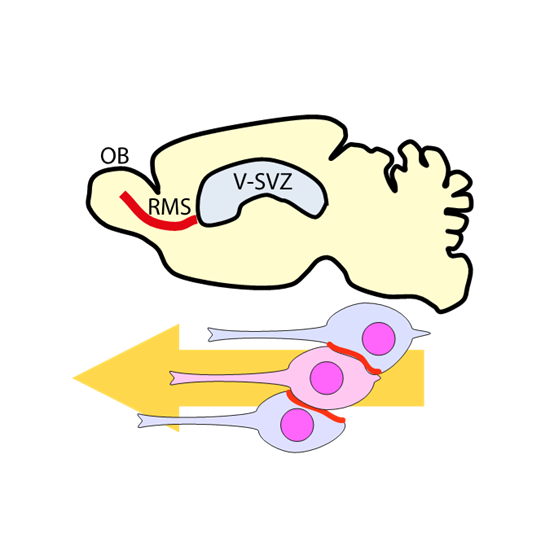
新生ニューロンの移動時の相互足場機構
-
2014
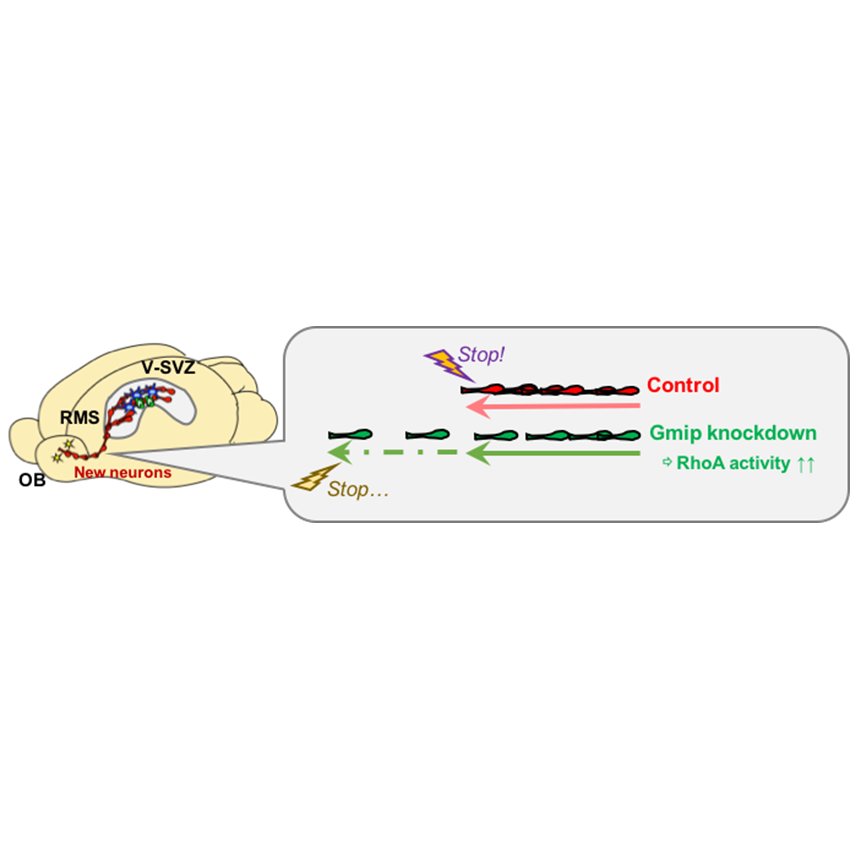
ニューロンの移動速度を調節する仕組み
-
2014
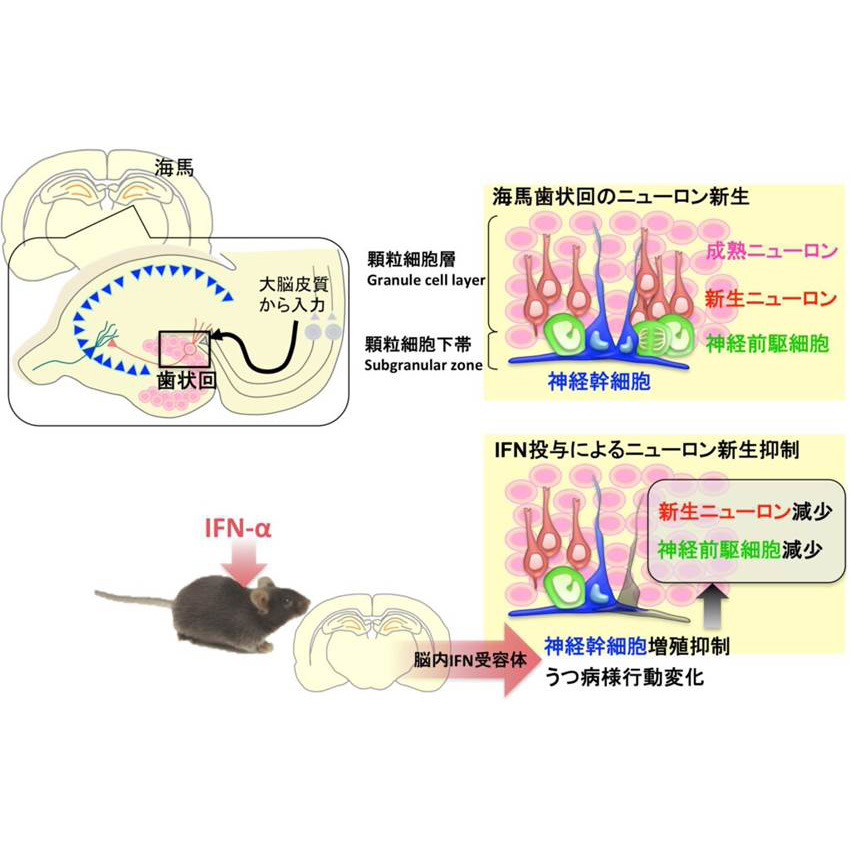
インターフェロンによるうつ病発症と成体ニューロン新生
-
2012
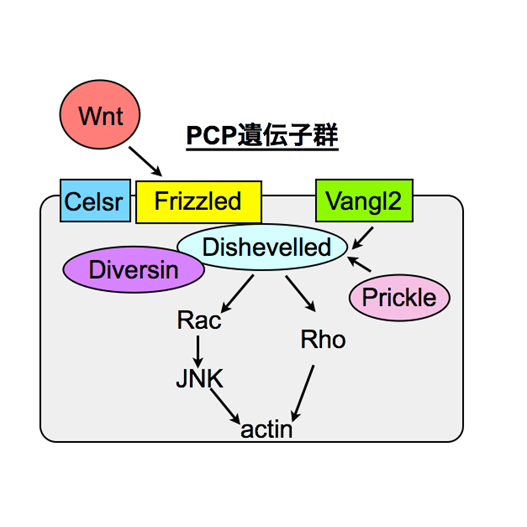
Dishevelled2とVanglを介した新生ニューロンの配置と樹状突起形成
-
2012

嗅球のニューロン新生の細胞特異的な臨界期
-
2012
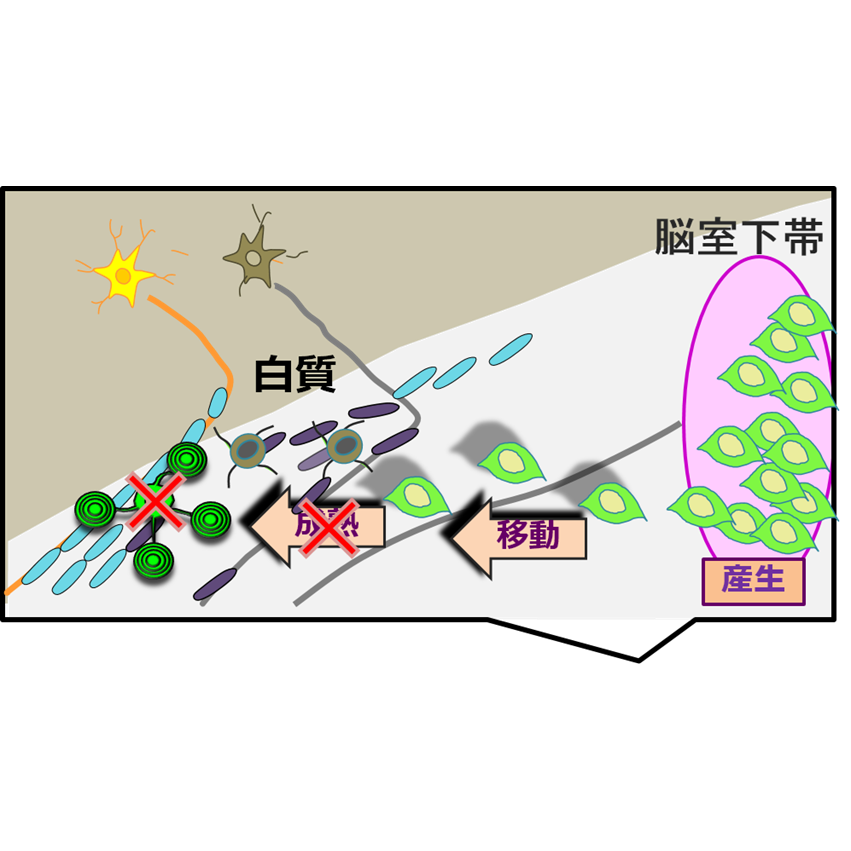
虚血低酸素後の新生仔マウスの脳室下帯におけるオリゴデンドロサイト前駆細胞の産生
-
2011

コモンマーモセットの脳室下帯及びrostral migratory streamの構造
-
2011
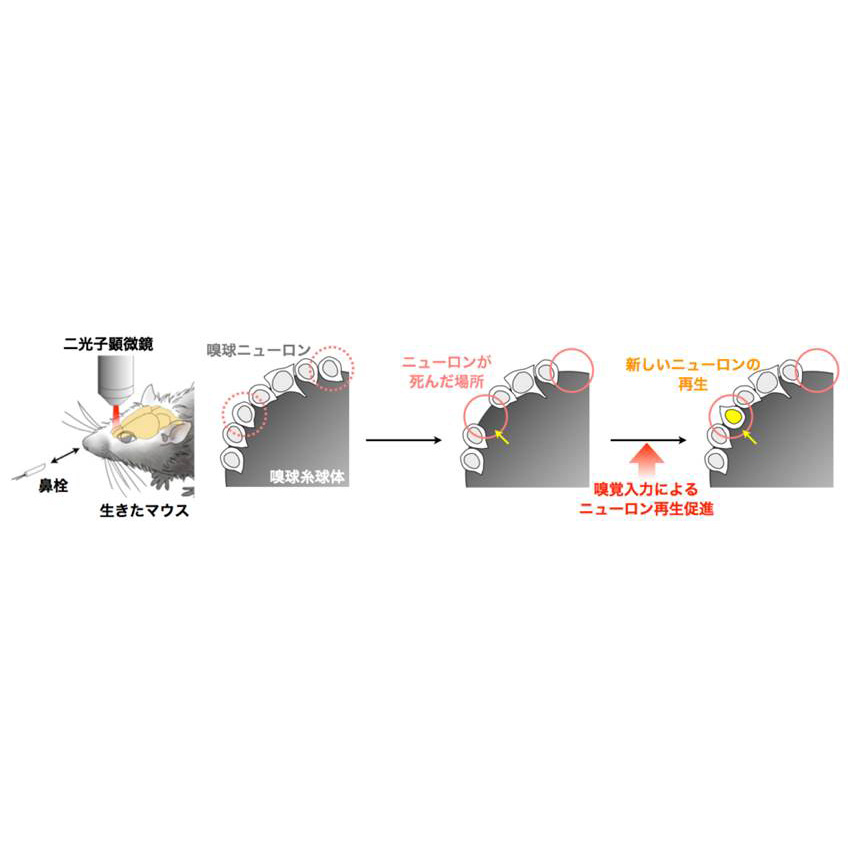
嗅覚入力によるニューロン再生促進
-
2010
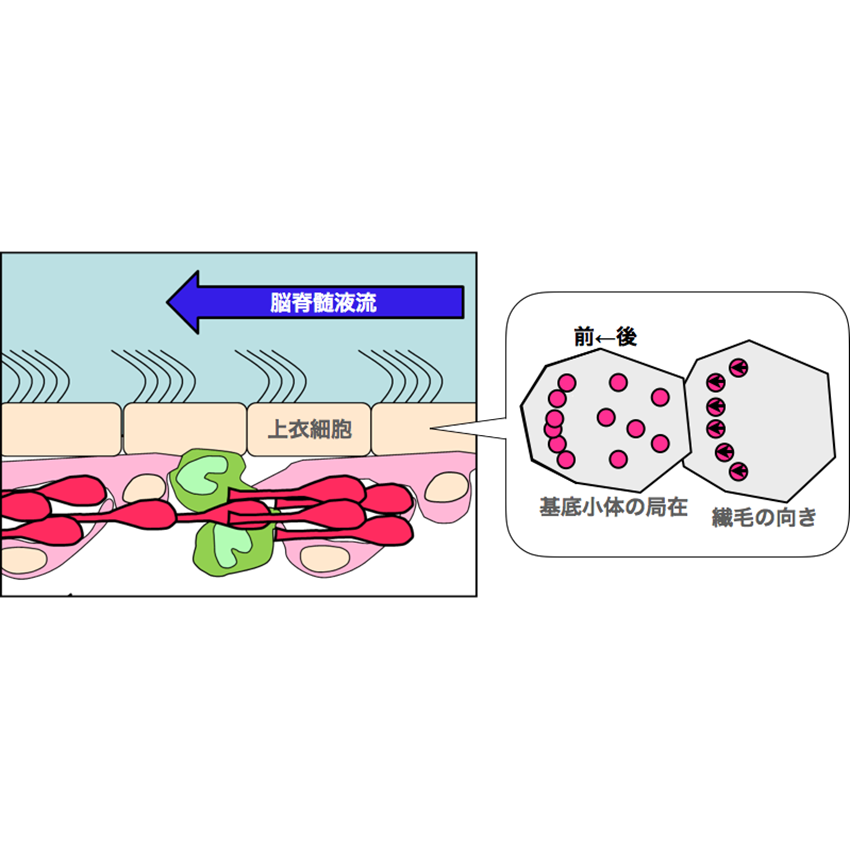
上衣細胞の繊毛の形成機構
-
2010
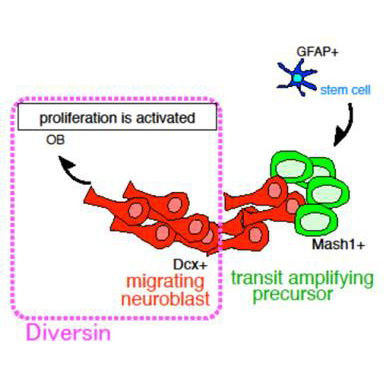
Wntシグナルの新規構成因子Diversinの発現
-
2010
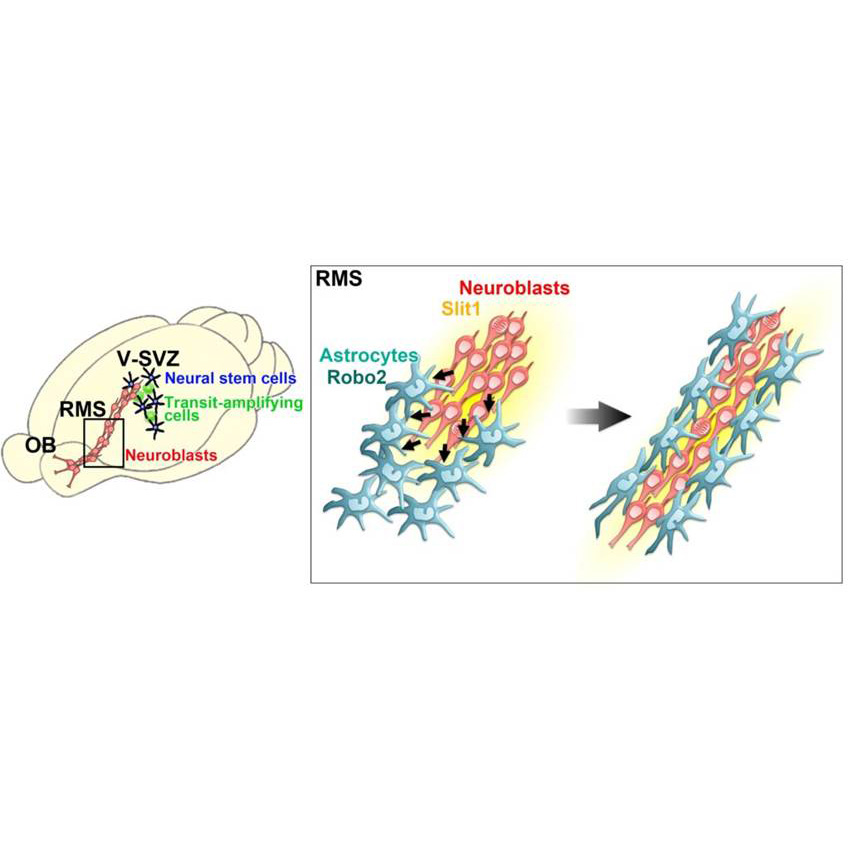
新生ニューロンのアストロサイトトンネル形成・維持機構
-
2007
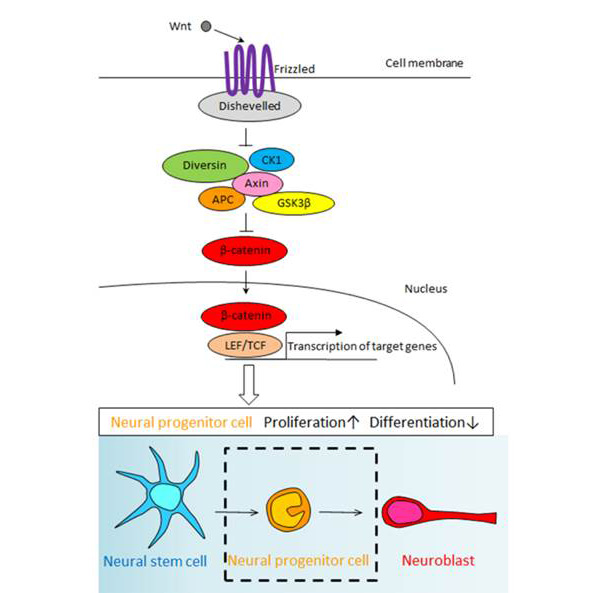
Wnt-β-cateninシグナルの神経新生への寄与
-
2007
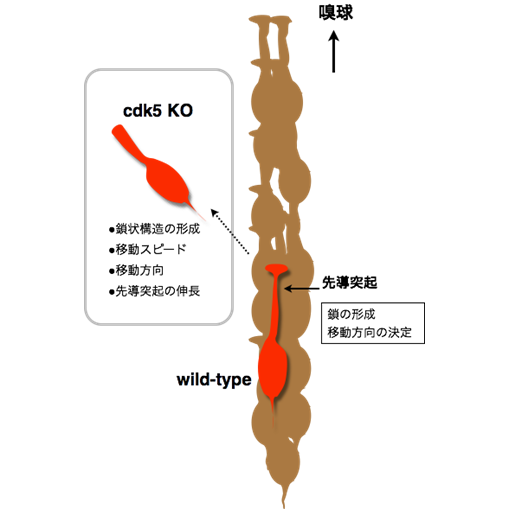
Cdk5の新生ニューロン移動における役割
-
2006
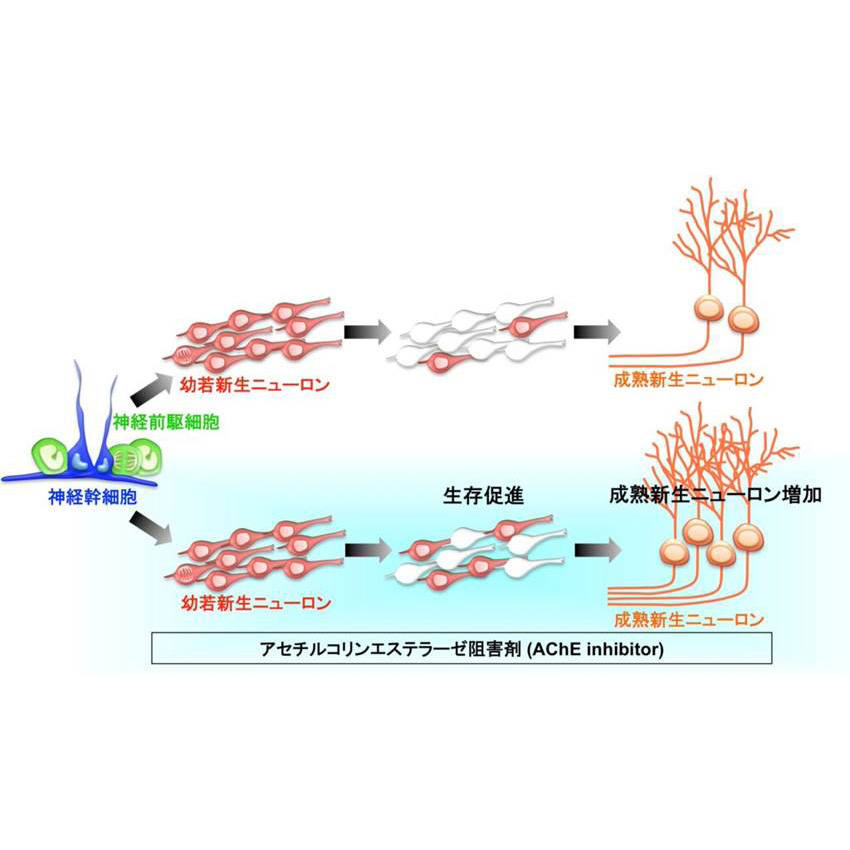
新生ニューロンの生存におけるアセチルコリンの役割
-
2006
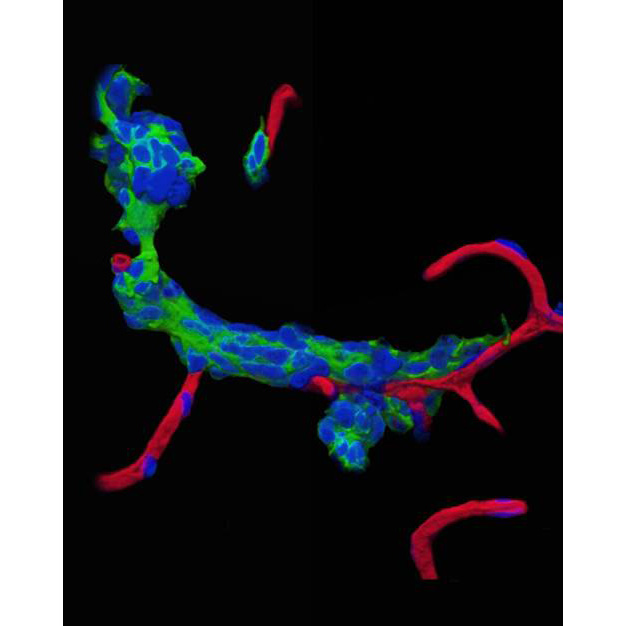
脳梗塞後のニューロン新生と虚血部への移動
-
2006

脳脊髄液流が新生ニューロンの移動方向に与える影響
お知らせ
-
- 2025.5.30
- 花王科学奨励賞を受賞しました!
-
- 2025.4.17
- 2025年度日本再生医療学会賞(基礎部門)を受賞しました!
-
- 2025.3.25
- ご卒業おめでとうございます!
-
- 2025.3.1
- 風戸研究奨励賞を受賞しました!
-
- 2025.2.20
- 第75回脳の医学・生物学研究会を開催しました!
-
- 2025.1.30
- 神経科学卓越研究グループキックオフシンポジウムを開催いたしました!
-
- 2024.12.17
- 第68回日本新生児生育医学会 学術集会 優秀演題賞を受賞しました!
-
- 2024.12.12
- 名古屋市立大学医学会賞を受賞しました!
-
- 2024.10.10
- 第75回 脳の医学・生物学研究会開催のお知らせ
-
- 2024.8.29
- NEURO2024 若手育成道場優秀発表賞を受賞しました!
-
- 2024.8.8
- 第8回バイオインダストリー奨励賞を受賞しました!
-
- 2024.7.11
- 第2回国際ニューロン新生研究拠点(NeuRIC)合同ミーティングを開催しました
-
- 2024.4.20
- 第23回日本再生医療学会総会 優秀演題賞を受賞しました!
-
- 2024.4.19
- 学生のための脳科学フェス開催のお知らせ
-
- 2024.3.22
- ご卒業おめでとうございます!
-
- 2023.12.28
- 2023年のBREAKTHROUGH OF THE YEAR受賞者は?
-
- 2023.12.4
- 第17回神経発生討論会・第20回成体脳のニューロン新生懇談会 合同大会のお知らせ
-
- 2023.12.4
- 令和5年度名古屋市立大学医学会総会 医学会賞を受賞しました!
-
- 2023.12.1
- 基礎自主研修大成功!
-
- 2023.9.4
- 第73回 脳の医学・生物学研究会を開催しました。
-
- 2023.8.21
- 2023年 日本学術会議 第13回形態科学シンポジウムを開催しました
-
- 2023.7.24
- 澤本研究室 15周年記念の会を開催しました。
-
- 2023.5.10
- 学部生の榑松さんがポスター発表優秀演題賞を受賞しました
-
- 2023.3.30
- Konstantin Khodosevich先生が帰国されました
-
- 2023.3.24
- ご卒業おめでとうございます!
-
- 2023.2.2
- 脳傷害後の神経再生を促す超分子バイオマテリアルの開発に成功
-
- 2022.12.28
- 忘年会の代わりにオンラインで表彰式を行いました
-
- 2022.12.17
- 鈴木さんありがとうございました!
-
- 2022.11.25
- 基礎自主研修大成功!
-
- 2022.9.16
- 澤本研15周年記念誌を作成しました
-
- 2022.7.25
- ミクログリアはホスファチジルセリン依存的に成体新生ニューロンのシナプスを貪食する
-
- 2022.5.16
- 学部生の斎藤明里さんが瑞秀賞を受賞しました。
-
- 2022.3.23
- 助教または講師(助教級)候補者の公募
-
- 2022.2.25
- 大学院生がラボの雰囲気をご紹介します
-
- 2022.2.25
- 私たちの研究を日本語で解説しているサイトへのリンク
-
- 2022.2.20
- メンバーの受賞
-
- 2022.2.20
- メンバーの受賞
-
- 2022.2.2
- 脳傷害後の神経再生を促す超分子バイオマテリアルの開発に成功
-
- 2020.10.17
- 特任助教募集(本募集は締め切りました。ご応募ありがとうございました。)
-
- 2019.10.24
- 特任助教の募集(本募集は終了しました。ありがとうございました。)
-
- 2019.4.4
- 特任助教の募集
-
- 2019.2.7
- 再生医学分野 実験補助員(パートタイム職員)の募集
-
- 2018.12.13
- 脳梗塞後の神経再生メカニズムを発見 ―神経細胞の移動促進により神経機能が改善
-
- 2018.12.8
- 釣り(篠島)Fishing in Shinojima island
-
- 2018.10.17
- 生理学研究所研究会「神経発達・再生研究会」
-
- 2018.8.8
- 2018年度生理学研究所研究会 「神経発達・再生研究会」のご案内
-
- 2018.4.9
- Lab members 2018
-
- 2018.1.18
- 神経細胞の脳内の位置を決定するしくみ
-
- 2017.9.30
- 第26回 海馬と高次脳機能学会を開催しました
-
- 2017.4.22
- 釣り(福井)Fishing tour in Fukui
-
- 2016.10.18
- 実験補助員(パートタイム職員)の募集
-
- 2015.12.28
- 忘年会 End of Year party
-
- 2015.12.22
- バレンシア大学訪問 Visit to University of Valencia
-
- 2015.11.27
- ラボ旅行(鳥羽・伊勢) Lab trip to Toba and Ise
-
- 2015.9.21
- 日本神経化学会優秀発表賞
-
- 2015.8.2
- 第11回成体脳のニューロン新生懇談会 演題・参加登録受付中
-
- 2015.6.21
- バレンシア大学訪問
-
- 2015.6.16
- 神経再生イメージング技術開発研究会
-
- 2015.6.1
- 日本麻酔科学会最優秀演題賞
-
- 2015.3.25
- 2014年度 学位授与式
-
- 2014.12.24
- 高校生研究体験
-
- 2014.12.23
- 2014年度 名古屋市立大学医学会賞
-
- 2014.12.23
- Mark A. Smith Prize
-
- 2013.7.7
- 2015年度大学院新入生候補者の募集
-
- 2013.6.27
- 日仏交流
-
- 2013.2.19
- 【終了】実験補助員を1名募集します
-
- 2012.3.30
- 平成23年度学位授与式
-
- 2011.6.5
- 平成24年度大学院生候補者の募集
-
- 2011.6.1
- (終了)実験補助員を1名募集
-
- 2009.4.28
- 研究員募集終了
-
- 2009.4.2
- 研究員募集【終了しました】
-
- 2008.9.20
- ポスドク募集【終了しました。】
-
- 2008.5.15
- 平成21年度 修士・博士課程大学院生募集中(実験スタッフは募集終了しました)
-
- 2007.12.22
- 小島拓郎院生が受賞
-
- 2007.4.28
- 名古屋市立大学へ移転します
-
- 2006.12.7
- 公開研究報告会が開催されます